TUGAS TERSTRUKTUR
1. Menurut Louis de Broglie bahwa elektron mempunyai sifat gelombang sekaligus juga partikel. Jelaskan Keterkaitannya dengan teori mekanika kuantum dan teori orbital molekul?
Jawaban:
Louis de Broglie (1924) menjelaskan bahwa cahaya dapat
berada dalam suasana tertentu yang terdiri dari partikel-partikel, kemungkinan
berbentuk partikel pada suatu waktu, yang memperlihatkan sifat-sifat seperti
gelombang. Berikut pendapat Louis de
Broglie :
Einstein : E = mc2
Max Planck : E = h · ʋ
sehingga untuk menghitung panjang
gelombang satu partikel diperoleh :
λ = h / (m . ʋ)
dengan:
λ = panjang gelombang (m)
m = massa partikel (kg)
ʋ = kecepatan partikel (m/s)
h = tetapan Planck (6,626
× 10–34 Joule s)
Hipotesis de Broglie terbukti benar dengan
ditemukannya sifat gelombang dari elektron. Elektron mempunyai sifat difraksi
seperti halnya sinar–X. Sebagai akibat dari dualisme sifat elektron sebagai
materi dan sebagai gelombang, maka lintasan elektron yang dikemukakan Bohr
tidak dapat dibenarkan. Gelombang tidak bergerak menurut suatu garis, melainkan
menyebar pada suatu daerah tertentu.
Gagasan
ini adalah timbal balik daripada gagasan partikel cahaya yang dikemukakan Max
Planck. Louis de Broglie meneliti keberadaan gelombang melalui eksperimen
difraksi berkas elektron. Dari hasil penelitiannya inilah diusulkan “materi
mempunyai sifat gelombang di samping partikel”, yang dikenal dengan prinsip
dualitas.
Sifat
partikel dan gelombang suatu materi tidak tampak sekaligus, sifat yang tampak
jelas tergantung pada perbandingan panjang gelombang de Broglie dengan
dimensinya serta dimensi sesuatu yang berinteraksi dengannya. Pertikel yang
bergerak memiliki sifat gelombang. Fakta yang mendukung teori ini adalah petir
dan kilat. Kilat akan lebih dulu terjadi daripada petir. Kilat menunjukan sifat
gelombang berbentuk cahaya, sedangkan petir menunjukan sifat pertikel berbentuk
suara. Kelemahan dari teori atom Niels Bohr, yaitu tidak dapat menjelaskan
mengapa elektron hanya boleh berada pada tingkat energi tertentu.
Hipotesis
tentang gelombang materi berasal dari gagasan foton Einstein. Kemudian
diterapkan Louis de Broglie pada 1922, sebelum Compton membuktikannya, untuk
menurunkan Hukum Wien (1896). Ini menyatakan bahwa "bagian tenaga
elektromagnet yang paling banyak dipancarkan benda (hitam) panas adalah yang
frekuensinya sekitar 100 milyar kali suhu mutlak (273 + suhu Celsius) benda
itu". Pekerjaan ini ternyata memberi dampak yang berkesan bagi de Broglie.
Hipotesis Louis de Broglie dan azas ketidakpastian
dari Heisenberg merupakan dasar dari model Mekanika Kuantum (Gelombang) yang
dikemukakan oleh ERWIN SCHRODINGER pada tahun1927, yang mengajukan
konsep orbital untuk menyatakan kedudukan 1elektron dalam atom. Orbital
menyatakan suatu daerah dimana elektron paling mungkin (peluang terbesar) untuk
ditemukan.
Schrodinger sependapat dengan Heisenberg bahwa
kedudukan elektron dalam atom tidak dapat ditentukan secara pasti, namun yang
dapat ditentukan adalah kebolehjadian menemukan elektron pada suatu titik pada
jarak tertentu dari intinya. Ruangan yang memiliki kebolehjadian terbesar
ditemukannya elektron disebut Orbital.
Dalam mekanika kuantum, model orbital atom
digambarkan menyerupai “awan”. Beberapa orbital bergabung membentuk kelompok
yang disebut Subkulit. Persamaan gelombang ( Ψ= psi) dari Erwin
Schrodinger menghasilkan tiga bilangan gelombang (bilangan kuantum) untuk
menyatakan kedudukan (tingkat energi, bentuk, serta orientasi) suatu orbital,
yaitu: bilangan kuantum utama (n), bilangan kuantum azimut (l) dan bilangan
kuantum magnetik (m).
Teori orbital molekul adalah teori yang menjelaskan
ikatan kimia
melalui diagram orbital molekul. Sifat magnet dan sifat-sifat
molekul dapat dengan mudah dijelaskan dengan menggunakan pendekatan mekanika
kuantum lain yang disebut dengan teori orbital molekul.
Dalam mekanika kuantum, model orbital atom
digambarkan menyerupai “awan”. Beberapa orbital bergabung membentuk kelompok
yang disebut Subkulit. Persamaan gelombang ( Ψ= psi) dari Erwin Schrodinger
menghasilkan tiga bilangan gelombang (bilangan kuantum) untuk menyatakan
kedudukan (tingkat energi, bentuk, serta orientasi) suatu orbital, yaitu:
bilangan kuantum utama (n), bilangan kuantum azimut (l) dan bilangan kuantum
magnetik (m). Menurut persamaan fungsi gelombang ,
distribusi elektron dalam orbital dapat ditentukan melalui 3 bilangan kuantum
yaitu :
a.
Bilangan
kuantum utama (n = nomor lintasan elektron/kulit )
b.
Bilangan
kuantum azimuth (l = menunjukkan sub-lintasan/ sub- kulit)
c.
Bilangan
kuantum magnetic (m = harga orbital).
Awan elektron disekitar inti menunjukan tempat
kebolehjadian elektron. Orbital menggambarkan tingkat energi elektron.
Orbital-orbital dengan tingkat energi yang sama atau hampir sama akan membentuk
sub kulit. Beberapa sub kulit bergabung membentuk kulit.Dengan demikian kulit
terdiri dari beberapa sub kulit dan subkulit terdiri dari beberapa orbital.
Walaupun posisi kulitnya sama tetapi posisi orbitalnya belum tentu sama.
Keterkaitan yang tampak ialah mengenai sifat magnet dan sifat molekul.
Teori Atom Mekanika Kuantum
Model atom mekanika kuantum merupakan model
atom modern yang berkembang dan melengkapi kekurangan dari model atom
bohr. model atom modern didasarkan pada tiga hal berikut:
- menurut “Louis de Broglie”, elektron bersifat gelombang dan partikel.
- menurut “Werner Heisenberg”, dengan asas ketidakpastian bahwa ruang disekitar inti ditemukan elektron yang disebut orbital.
- menurut “Erwin Schrodinger”, mengenai persamaan gelombang elektron dalam atom.
Dari ketiga hal diatas, maka diperoleh model atom modern sebagai berikut:
- elektron-elektron mengitari inti atom dan berada pada orbital-orbital tertentu yang membentuk kulit atom.
- orbital merupakan ruang disekitar inti dimana elektron dapat ditemukan.
- kedudukan elektron pada orbital-orbitalnya dinyatakan dengan bilangan kuantum.
HUBUNGAN TEORI MEKANIKA KUANTUM DENGAN TEORI KETIDAKPASTIAN
Dari teori mekanika kuantum Werner
Heisenberg (1927) seorang ahli fisika dari Jerman membuktikan bahwa
tidak mungkin menentukan dengan pasti posisi elektron dan momentumnya.
Heseinberg menunjukkan bahwa usaha untuk mengukur posisi elektron akan
menganggu elektron itu.Hal ini menimbulkan ketidakpastian pada nilai
momentum.Usaha yang dilakukan untuk mengukur momentum dengan tepat juga
menimbulkan ketidakpastian dalam lokasi elektron dan inilah yang dikenal
dengan Prinsip Ketidakpastian Heisenberg. Hal ini
menunjukkan bawa tidak benar jika elektron menempati orbital yang jelas
dan pasti dalam gerakannya mengelilingin inti seperti yang pernah
dikemukakan oleh teori atom Bohr.
2. Bila absorpsi sinar UV
oleh iakatn rangkap menghasilkan promosi elektron ke orbital yang
berenergi lebih tinggi. Transisi elektron manakah memerlukan energi terkecil
bila sikloheksena berpindah ke tingkat tereksitasi
Jawab :
Penyerapan
sinar tampak atau UV menyebabkan terjadinya eksitasi molekul dari ground state
(energi dasar) ke tingkat Exited state (energi yang lebih tinggi.
Pengabsorbsian sinar UV atau sinar tampak oleh suatu molekul menghasilkan
eksitasi elektron bonding. Akibatnya panjang gelombang absorbsi maksimum dapat
dikorelasikan dengan jenis ikatan yang ada dalam molekul yang diselidiki. Oleh
karena itu spektroskopi serapan molekul berguna untuk mengidentifikasi gugus
fungsional yang ada dalam suatu molekul. Akan tetapi yang lebih penting adalah
penggunaan spektroskopi serapan UV dan sinar tampak untuk penentuan kuantitatif
senyawa-senyawa yang mengandung gugus pengabsorbsi.
Pada transisi elektronik inti-inti atom dapat dianggap
berada pada posisi yang tepat. Hal ini dikenal dengan prinsip Franck-Condon.
Disamping itu dalam proses transisi ini tidak semua elektron ikatan
terpromosikan ke orbital antiikatan.
Berdasarkan jenis orbital tersebut maka, jenis-jenis
transisi elektronik dibedakan menjadi empat macam, yakni:
1) Transisi σ → σ*
2) Transisi π → π*
3) Transisi n → π*
4) Transisi n → σ*
Transisi elektronik menimbulkan spektra serapan pada daerah
sinar tampak dan ultra violet pada senyawa-senyawa organik. Umumnya dalam
molekul poliatomis terutama dalam molekul organik, orbital pengikatan atom
bukan pengikatan di isi sehingga transisi elektron dengan panjang gelombang
terpanjang melibatkan pengikatan elektron dari orbital molekul tidak terisi
yang tertinggi ke orbital molekul tidak terisi yang terendah.
Mengapa diisebut transisi elektronik karena elektron yang
menempati satu orbital dengan energi terendah dapat berpindah ke orbital lain
yang memiliki energi lebih tinggi jika menyerap energi, begitupun sebaliknya
elektron dapatberpindah dari orbital yang memiliki energi lebih rendah jika
melepaskan energi. Bila
absorpsi sinar UV oleh ikatan rangkap menghasilkan promosi
elektron ke orbital yang berenergi lebih tinggi dan jika
terjadi Absorpsi / Penyerapan pada sinar
tampak atau UV, hal ini akan menyebabkan terjadinya eksitasi molekul
dari energi dasar ke tingkat energi yang lebih tinggi.pada proses ini, penyerapan
sinar UV atau sinar tampak oleh suatu molekul akan menghasilkan eksitasi elektron
bonding. hal ini akan mengakibatkan panjang gelombang absorbsi maksimum dapat dikorelasikan
dengan jenis ikatan yang ada dalam molekul yang diidentifikasi. Oleh karena itu
spektroskopi serapan molekul dapat berguna untuk mengidentifikasi gugus fungsional
yang ada dalam suatu molekul. Akan tetapi yang lebih penting adalah penggunaan
spektroskopi serapan UV dan sinar tampak untuk penentuan kuantitatif
senyawa-senyawa yang mengandung gugus pengabsorbsi.
Pada zat-zat pengabsorbsi ini berkaitan dengan tiga jenis transisi elektron, yaitu elektron-elektron π, σ, dan n, yang meliputi molekul atau ion organik dan sejumlah anorganik. Penyelidikan spektroskopi senyawa-senyawa organik dilakukan pada daerah UV yang panjang gelombangnya lebih besar dari 185nm. Energi yang diterima atau diserap berupa radiasi elektromagnetik.
Pada zat-zat pengabsorbsi ini berkaitan dengan tiga jenis transisi elektron, yaitu elektron-elektron π, σ, dan n, yang meliputi molekul atau ion organik dan sejumlah anorganik. Penyelidikan spektroskopi senyawa-senyawa organik dilakukan pada daerah UV yang panjang gelombangnya lebih besar dari 185nm. Energi yang diterima atau diserap berupa radiasi elektromagnetik.
Bila
2 orbital atom bergabung maka salah satu orbital molekul bonding berenergi
rendah atau orbital molekul anti bonding berenergi tinggi dihasilkan. Orbital
molekul yang diasosiasikan dengan ikatan tunggal dalam molekul organik ditandai
dengan orbital sigma dan elektron yang terlibat adalah elektron sigma.


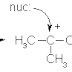
anda menyatakan bila 2 orbital atom bergabung maka salah satu orbital molekul bonding berenergi rendah atau orbital molekul anti bonding berenergi tinggi dihasilkan. Orbital molekul yang diasosiasikan dengan ikatan tunggal dalam molekul organik ditandai dengan orbital sigma dan elektron yang terlibat adalah elektron sigma. kenapa hal ini dapat terjadi?
BalasHapus
HapusEnergy yang dimiliki sinar UV mampu menyebabkan perpindahan electron (promosi electron) atau dapat disebut transisi elektronik. Transisi elektronik dapat diartikan sebagai perpindahan electron dari satu orbital ke orbital yang lain. Disebut transisi elektronik karena electron yang menempati satu orbital dengan energy terendah dapat berpindah ke orbital lain yang memiliki energy lebih tinggi jika menyerap energy, begitupun sebaliknya jika melepaskan energy. Energy yang diterima atau diserap berupa radiasi elektromagnetik. Adssorpsi sinar UV mengakibatkan eksitasi molekul dari energy dasar ke energy yang lebih tinggi. Ketika berpindah dari orbital yang satu ke orbital yang lain dengan memancarkan gelombang elektromagnetik. Ketika berpindah dari orbit yang luar ke yang dalam electron akan memancarkan energy sebesar E = h.f, dengan f ialah frekuensi gelombang yang dipancarkan. Disamping itu dalam proses transisi ini tidak semua electron ikatan terpromosikan ke orbital antiikatan.
Berdasarkan jenis orbital tersebut maka, jenis-jenis transisi elektronik dibedakan menjadi empat macam, yakni:
Transisi σ → σ*
Transisi π → π*
Transisi n → π*
Transisi n → σ*
Keterangan
· σ : senyawa-senyawa yang memiliki ikatan tunggal
· π : senyawa-senyawa yang memiliki ikatan rangkap
· n menyatakan orbital non-ikatan: untuk senyawa-senyawa yang memiliki elektron bebas.
· σ* dan π* merupakan orbital yang kosong (tanpa elektron), orbital ini akan terisi elektron ketika telah atau bila terjadi eksitasi elektron atau perpindahan elektron atau promosi elektron dari orbital ikatan. Pada zat-zat pengabsorbsi ini berkaitan dengan tiga jenis transisi elektron, yaitu elektron-elektron π, σ, dan n, yang meliputi molekul atau ion organik dan sejumlah anorganik. Penyelidikan spektroskopi senyawa-senyawa organik dilakukan pada daerah UV yang panjang gelombangnya lebih besar dari 185nm. Dan bila 2 orbital atom bergabung maka salah satu orbital molekul bonding berenergi rendah atau orbital molekul anti bonding berenergi tinggi dihasilkan. Orbital molekul yang diasosiasikan dengan ikatan tunggal dalam molekul organik ditandai dengan orbital sigma dan elektron yang terlibat adalah elektron sigma.
Seperti apa energi yang diserap sinar UV?
BalasHapusKetika sinar melewati suatu senyawa, energi dari sinar digunakan untuk mendorong perpindahan elektron dari orbital ikatan atau orbital non-ikatan ke salah satu orbital anti-ikatan yang kosong.
BalasHapusPerpindahan/lompatan elektron yang mungkin terjadi akibat adanya sinar adalah:
Pada tiap kemungkinan, suatu elektron tereksitasi dari orbital yang terisi penuh ke orbital anti-ikatan yang kosong. Tiap lompatan elektron memerlukan energi dari sinar, dan lompatan yang besar pasti membutuhkan energi yang lebih besar dari pada lompatan yang kecil.
Tiap panjang gelombang sinar mempunyai energi yang khas. Jika besarnya energi tersebut cukup untuk membuat suatu lompatan, maka panjang gelombang akan diserap – energinya akan digunakan untuk promosi satu elektron.
Kita perlu mengetahui hubungan antara perbedaan energi dan panjang gelombang yang diserap. Apakah dengan perbedaan energi yang lebih besar sinar yang panjang gelombangnya lebih rendah akan diserap – atau bagaimana?
Akan lebih mudah jika diawali dengan melihat hubungan antara frekuensi sinar yang diserap dan energinya:
Anda dapat melihat bahwa jika anda menginginkan lompatan energi yang tinggi, anda akan menyerap sinar dengan frekuensi yang lebih tinggi. Frekuensi yang lebih tinggi, berarti energinya lebih tinggi.
Hal itu mudah – tetapi sayangnya spektra serapan UV-tampak selalu menggunakan panjang gelombang bukan frekuensi. Ini artinya bahwa anda perlu mengetahui hubungan antara panjang gelombang dan frekuensi.
Anda dapat melihat dari persamaan ini bahwa frekuensi yang lebih tinggi akan mempunyai panjang gelombang yang lebih rendah.
Jadi . . . jika anda mempunyai lompatan energi yang lebih besar, anda akan menyerap sinar dengan frekuensi yang lebih tinggi – dapat dikatakan juga bahwa anda akan menyerap sinar dengan panjang gelombang yang lebih rendah.
Diagram berikut menunjukan spektrum serapan sederhana buta-1,3-diena – molekul yang telah kita bahas sebelumnya. Absorbansi (pada sumbu tegak) adalah ukuran banyaknya sinar yang diserap. Nilai yang lebih tinggi, berarti lebih banyak panjang gelombang khas yang diserap.
Anda akan melihat puncak serapan pada 217 nm. Ini berada pada daerah ultra-violet dan tidak ada tanda yang menunjukan penyerapan pada daerah sinar tampak – buta-1,3-diena tidak berwarna. Anda mendapatkan puncak pada grafik dengan simbol “lambda-max”.
Pada buta-1,3-diena, CH2=CH-CH=CH2, tidak ada elektron non-ikatan. Artinya lompatan elektron yang terjadi hanya (dalam kisaran yang dapat diukur oleh spektrometer) dari orbital pi ikatan ke orbital pi anti-ikatan.
Saya akan menambahkan soal no. 2
BalasHapusSpektrofotometri UV merupakan salah satu metode analisis yang dilakukan dengan pangjang gelombang 100-400 nm atau 595–299 kJ/mol. Sinar ultraviolet atau sinar ungu terbagi menjadi dua jenis yaitu
· Ultraviolet jauh
· Ultaviolet dekat
Ultraviolet jauh memiliki rentang panjang gelombang ± 10 – 200 nm, sedangkan ultraviolet dekat memiliki rentang panjang gelombang ± 200-400 nm. Cahaya UV tidak bisa dilihat oleh manusia, namun beberapa hewan, termasuk burung, reptil dan serangga seperti lebah dapat melihat sinar pada panjang gelombang UV.
Pada spektrofotometer UV biasanya menggunakan lampu deuterium atau disebut juga heavi hidrogen sebagai sumber cahaya. Deuterium merupakan salah satu isotop hidrogen yang memiliki 1 proton dan 1 neutron pada intinya. Deuterium berbeda dengan hidrogen yang hanya memiliki 1 neutron tanpa proton. Air yang atom hidrogennya merupakan isotop deuterium dinamakan air berat (D2O).Transisi Elektronik adalah Energi yang dimiliki sinar UV mampu menyebabkan perpindahan elektron (promosi elektron) atau yang disebut transisi elektronik. Transisi elektronik dapat diartikan sebagai perpindahan elektron dari satu orbital ke orbital yang lain.
Disebut transisi elektronik karena elektron yang menempati satu orbital dengan energi terendah dapat berpindah ke orbital lain yang memiliki energi lebih tinggi jika menyerap energi, begitupun sebaliknya elektron dapat berpindah dari orbital yang memiliki energi lebih rendah jika melepaskan energi. Energi yang diterima atau diserap berupa radiasi elektromagnetik.
Berdasarkan simetri da
Mengapa sinar uv berrbahaya?. Dan apakah bahayanya tidak hanya di rasakan oleh manusia saja??
BalasHapusEnergy yang diterima atau diserap berupa radiasi elektromagnetik. Berikan cobtoh dari radiasi elektromagnetik ?
BalasHapusAs stated by Stanford Medical, It's really the one and ONLY reason women in this country live 10 years more and weigh an average of 19 kilos less than we do.
BalasHapus(And realistically, it really has NOTHING to do with genetics or some secret exercise and really, EVERYTHING related to "how" they are eating.)
BTW, What I said is "HOW", not "what"...
Tap on this link to determine if this little questionnaire can help you find out your real weight loss possibilities