KLASIFIKASI SENYAWA ORGANIK
Senyawa organik adalah
senyawa yang banyak mengandung unsur karbon
dan unsur lainnya seperti hidrogen, oksigen, nitrogen, belerang, dan fosfor
dalam jumlah sedikit. Ada jutaan
senyawa organik dan untuk mempermudah dalam mempelajarinya, senyawa organik
diklasifikasikan kedalam berbagai kelompok dan sub kelompok. Secara umum,
senyawa organik dikategorikan sebagai berikut:
A. Senyawa Rantai Terbuka (Alifatik)
Senyawa
ini mengandung sistem rantai terbuka dari atom karbon. Rantai dapat berupa
rantai lurus (tidak bercabang), atau bercabang. Senyawa rantai terbuka disebut
senyawa alifatik. Alifatik berasal dari bahasa Yunani Aleiphar yang berarti
lemak, sebagaimana senyawa ini sebelumnya diperoleh dari lemak hewani atau
nabati
Senyawa alifatik dibedakan menjadi :
- Hidrokarbon jenuh/tersaturasi adalah hidrokarbon yang paling sederhana. Hidrokarbon ini seluruhnya terdiri dari ikatan tunggal dan terikat dengan hidrogen. Rumus umum untuk hidrokarbon tersaturasi adalah CnH2n+2.Hidrokarbon jenuh merupakan komposisi utama pada bahan bakar fosil dan ditemukan dalam bentuk rantai lurus maupun bercabang. Hidrokarbon dengan rumus molekul sama tapi rumus strukturnya berbeda dinamakan isomer struktur.
- Hidrokarbon tak jenuh/tak tersaturasi adalah hidrokarbon yang memiliki satu atau lebih ikatan rangkap, baik rangkap dua maupun rangkap tiga. Hidrokarbon yang mempunyai ikatan rangkap dua disebut dengan alkena, dengan rumus umum CnH2n.Hidrokarbon yang mempunyai ikatan rangkap tiga disebut alkuna, dengan rumus umum CnH2n-2.
Hidrokarbon alkana, alkena dan alkuna adalah senyawa alifatik, seperti asam lemak dan banyak senyawa lainnya. Kebanyakan senyawa yang mengandung cincin adalah senyawa aromatik. Dengan demikian, senyawa alifatik adalah kebalikan dari senyawa aromatik.
- Alkana
Alkana merupakan hidrokarbon alifatik jenuh. Kelompok senyawa ini sering disebut parafin karena sifatnya yang kurang reaktif. (Parafin berasal dari kata “parum” berarti sedikit, dan “affinis” berarti gabung; atau “parum affinis” yang berarti “berdaya gabung kecil”.) Semua senyawa alkana memiliki rumus umum CnH2n+2 dimana n adalah jumlah atom karbon. Senyawa alkane yang paling sederhana adalah metana (CH4). Seluruh atom H membentuk 4 ikatan sigma pada satu atom karbon, mengalami hibridisasi sp3 dengan bangun molekul tetrahedral.
- Sifat-sifat Alkana
- Hidrokarbon jenuh (tidak ada ikatan atom C rangkap sehingga jumlah atom H nya maksimal)
- Disebut golongan parafin karena affinitas kecil (sedikit gaya gabung)
- Sukar bereaksi
- Bentuk Alkana dengan rantai C1 – C4 pada suhu kamar adalah gas, C4 – C17 pada suhu adalah cair dan > C18 pada suhu kamar adalah padat
- Titik didih makin tinggi bila unsur C nya bertambah…dan bila jumlah atom C sama maka yang bercabang mempunyai titik didih yang lebih rendah
- Sifat kelarutan : mudah larut dalam pelarut non polar
- Massa jenisnya naik seiring dengan penambahan jumlah unsur C
- Merupakan sumber utama gas alam dan petrolium (minyak bumi)
- Deret homolog alkana
Deret homolog adalah suatu
golongan/kelompok senyawa karbon dengan rumus umum yang sama, mempunyai sifat
yang mirip dan antar suku-suku berturutannya mempunyai beda CH2 atau dengan
kata lain merupakan rantai terbuka tanpa cabang atau dengan cabang yang nomor
cabangnya sama.
Sifat-sifat deret homolog alkana :
- · Mempunyai sifat kimia yang mirip
- Mempunyai rumus umum yang sama
- Perbedaan Mr antara 2 suku berturutannya sebesar 14
- Makin panjang rantai karbon, makin tinggi titik didihnya
• Bahan bakar
• Pelarut
• Sumber hidrogen
• Pelumas
• Bahan baku untuk senyawa organik
lain
• Bahan baku industri
Contoh alkana :
- Alkena
Alkena atau olefin dalam kimia organik adalah hidrokarbon tak jenuh dengan sebuah ikatan rangkap dua antara atom karbon. Alkena asiklik yang paling sederhana, yang membentuk satu ikatan rangkap dan tidak berikatan dengan gugus fungsional manapun, maka akan membentuk suatu kelompok hidrokarbon dengan rumus umum CnH2n.Alkena yang paling sederhana adalah etena atau etilena (C2H4) Senyawa aromatik seringkali juga digambarkan seperti alkena siklik, tapi struktur dan ciri-ciri mereka berbeda sehingga tidak dianggap sebagai alkena.Alkena yang paling sederhana yakni adalah atena (C2H4). Membentuk 3 ikatan sigma dan 1 ikatan pi yang terjadi pada satu atom karbon dan memiliki hibridisasi sp2 .
- Sifat-sifat Alkena
- Hidrokarbon tak jenuh ikatan rangkap dua
- Alkena disebut juga olefin (pembentuk minyak)
- Sifat fisiologis lebih aktif (sbg obat tidur –> 2-metil-2-butena)
- Sifat sama dengan Alkana, tapi lebih reaktif
- Sifat-sifat : gas tak berwarna, dapat dibakar, bau yang khas, eksplosif dalam udara (pada konsentrasi 3 – 34 %)
- Terdapat dalam gas batu bara biasa pada proses “cracking”
- Dapat digunakan sebagai obat bius (dicampur dengan O2)
- Untuk memasakkan buah-buahan
- bahan baku industri plastik, karet sintetik, dan alkohol.
Contoh alkena:
- Alkuna
Alkuna merupakan deret senyawa hidrokarbon tidak jenuh yang dalam tiap molekulnya mengandung satu ikatan rangkap 3 diantara dua atom C yang berurutan. Untuk membentuk ikatan rangkap 3 atau 3 ikatan kovalen diperlukan 6 elektron, sehingga tinggal satu elektron pada tiap-tiap atom C tersisa untuk mengikat atom H. Jumlah atom H yang dapat diikat berkurang dua, sehingga rumus umumnya menjadi : CnH2n+2 - 4H = CnH2n-2
Alkuna yang paling sederhana adalah metuna (C2H2). Membentuk 2 ikatan sigma dan 2 ikatan pi dalam satu atom karbonnya dan memiliki hibridisasi sp. Sifat alkuna sama dengan Alkena namun lebih reaktif. Rumus umumnya CnH2n-2. Tata namanya juga sama dengan Alkena, namun akhiran -ena diganti –una.
Kegunaan Alkuna sebagai :
- etuna (asetilena = C2H2) digunakan untuk mengelas besi dan baja.
- untuk penerangan
- Sintesis senyawa lain.
Contoh alkuna :
Dalam
senyawa rantai terbuka, gugus-gugus yang terikat pada ikatan sigma dapat
berotasi mengitari ikatan tersebut. Oleh karena itu atom-atom tersebut pada
molekul rantai terbuka kita dapat mengasumsikan berbagai macam posisi secara
relatip gugus yang satu terhadap yang lain. Misal senyawa sederhana etana,
dapat memiliki banyak isomer konformasi. Isomer konformasi adalah
senyawa-senyawa yang memiliki rumus molekul, rumus bangun, sifat kimia dan
sifat fisika yang sama tetapi berbeda posisi gugusnya secara ruang akibat
rotasi bebas melalui ikatan tunggal. Untuk menggambarkan konformasi dapat
digunakan dua tipe formula yaitu flying
wedge drawind dan proyeksi Newman.
Sebelumnya
digambar secara proyeksi Fischer lebih dahulu.
Rumus
molekul CH4 dan C2H6
Ket
Gambar; Garis mendatar berarti ikatan keluar bidang menuju si peninjau.
Sedangkan garis ke atas berarti ikatan keluar bidang menuju miring ke atas
menjauhi si peninjau dan garis ke bawa berarti keluar bidang miring ke bawah
menjauhi si peninjau.
B. Senyawa Rantai
Tertutup (Siklik)
Rantai siklik dalam kimia menunjukkan rumus
bangun senyawa atau gugus yang memiliki rantai karbon tertutup, baik berbentuk
lingkaran maupun cincin. Penggunaannya dikontraskan dengan rantai alifatik.
Senyawa rantai tertutup terbagi menjadi dua
jenis yaitu: Senyawa homosiklik, dan senyawa heterosiklik.
Senyawa aromatik adalah
kelas bahan kimia yang ditandai dengan memiliki struktur molekul yang disebut
cincin benzena. Yang paling sederhana adalah kimiawi benzena, dan struktur
hidrokarbon ini meminjamkan nama menjadi cincin benzena. Benzena adalah senyawa
induk dari keluarga besar senyawa organik yang dikenal sebagai senyawa
aromatik. Tidak seperti sikloheksana, benzena hanya berisi enam atom hidrogen,
memberikan kesan bahwa cincin itu adalah tak jenuh dan setiap atom karbon
berpartisipasi dalam satu ikatan rangkap. Dua struktur yang berbeda dengan
ikatan tunggal dan ganda sekitar cincin dapat ditulis kembali untuk benzena.
C. Senyawa Homosiklik
Senyawa
hidrokarbon siklik adalah senyawa karbon yang rantai C nya melingkar dan
lingkaran itu mungkin juga mengikat rantai samping. Golongan ini terbagi lagi
menjadi senyawa alisiklik dan aromatik. senyawa alisiklik yaitu senyawa
karbon alifatik yang membentuk rantai tertutup.
Senyawa ini mengandung satu atau lebih rantai tertutup (cincin) dan dikenal sebagai senyawa siklik, terdiri dari dua jenis:
Senyawa ini mengandung satu atau lebih rantai tertutup (cincin) dan dikenal sebagai senyawa siklik, terdiri dari dua jenis:
Senyawa-senyawa dimana cincin hanya terdiri dari atom carbon. Senyawa homosiklik atau senyawa karbosiklik dibagi menjadi senyawa alisiklik dan senyawa aromatik.
- Senyawa AlisiklikSenyawa alisiklik yaitu senyawa karbon alifatik yang membentuk rantai tertutup. Dimana sebuah cincin beranggota tiga atau lebih atom karbon menyerupai senyawa alifatik. Hidrokarbon alisiklik jenuh memiliki rumus CnH2n . Contoh senyawa asiklik adalah siklopropana, siklobutana, sikloheksana.
Sifat-sifat senyawa aromatik
1. Sifat fisis
- zat cair tidak berwarna
- memiliki bau yang khas
- mudah menguap
- benzene digunakan sebagai pelarut
- tidak larut dalam pelarut polar seperti air tetapi larut dalam senyawa yang kurang polar seperti eter dan tetraklorometana.
- larut dalam berbagai pelarut organik
- benzena dapat membentuk campuran azeotrop dengan air
- densitas : 0,88
- 2. sifat kimia
- bersifat toksik karsinogenik ( hati-hati menggunakan benzena sebagai pelarut hanya gunakan jika tidak ada alternatif lain misalnya toluena .
- merupakan senyawa nonpolar
- tidak begitu reaktif tetapi mudah terbakar dengan menghasilkan banyak jelaga
- lebih mudah mengalami reaksi subtitusi dari pada adisi
D. Senyawa Heterosiklik
Senyawa
heterosiklik adalah senyawa siklik yang pada cincinnya terdapat atom hetero
seperti: N,O, S, B, P dan beberapa metalloid seperti Al, Sn, As, Cu dan
lain-lain. Senyawa heterosiklik berdasarkan aromatisitas juga ada yang aromatic
dan non aromatic. Senyawa heterosiklik yang paling banyak adalah dengan nama
atom hetero N (golongan Aza), O (golongan okso) dan S (golongan tio).

heterosiklik Ialah ketika lebih dari satu jenis atom berada dalam satu senyawa cincin. Dalam senyawa ini umumnya satu atau lebih atom unsur seperti Nitrogen, Oksigen, atau Sulfur ada di dalam cincin. Atom selain karbon yang ada di dalam cincin disebut heteroatom. Senyawa heterosiklik selanjutnya dapat diklasifikasikan sebagai monosiklik, bisiklik dan trisiklik tergantung pada jumlah atom penyusun cincin satu, dua dan tiga.

Tatanama senyawa heterosiklik
Secara
umum senyawa heterosiklik mempunyai aturan dalam tatanama baik secara TRIVIAI,
maupun secara IUPAC. Secara umum maka penamaan heterosiklik diawali dengan aza
untuk heterosiklik N, Okso (Oxo) untuk heterosiklik O dan Tio (Tia) untuk
heterosiklik S. penamaan juga didasarkan pada jumlah cincin yaitu monosiklik
dan polisiklik.
- Cincin Monosiklik
Tatanama
untuk senyawa monosiklik adalah dengan menyebutkan ukuran cincin, jenis dan
posisi heteroatom dengan memberi awalan dengan aturan atau pedoman berikut.
- Ukuran cincin adalah merupakan pokok sesuai dengan ukuran cincin dengan ketentuan untuk masing-masing ukuran cincin: 3,4,5,6,7,8,9, dan 10 adalah; ir, et, ol, in, ep, oc, on, dan ec.
- Jenis hetero atom ditandai dengan awalan: oksa (oxa) untuk O, tio (tia) untuk S dan aza untuk N.
- Untuk lebih dari satu hetero atom yang sama diberi awalan: di, tri, tetra dan seterusnya seperti: dioksa, ditio, diaza dan seterusnya.
- Bila dalam suatu monoheterosiklik terdapat dua heteroatom yang berbeda maka urutan prioritas adalah: O > S > N, seperti: O – N (oksaza), S – N (tiaza) dan O – S (oksatio).
- Penomoran dimulai dari atom hetero dan perputaran ke arah posisi substituent dengan jumlah nomor terkecil dan berlaku untuk 2 atau lebih atom hetero yang sama. Bila terdapat dua atau lebih atom hetero yang berbeda maka gunakan atura (4).
- Senyawa yang diperoleh dari hasil hidrogenasi maka diberi awalan dihidro, tetrahidro dan seterusnya sesuai jumlah atom hydrogen yang ditambahkan kemudian diikuti nama induk yang terhidrogenasi.
Tatanama
untuk senyawa mono heterosiklik juga tergantung derajat ketidak jenuhan
sekaligus juga tergantung keberadaan N dalam heterosiklik tersebut yang
semuanya (termasuk aturan 1—6) disajikan dalam tabel
Contoh:
- Cincin Polisiklik
Poliheterosiklik
adalah senyawa heterosiklik yang mengandung dua system cincin atau lebih. Dalam
tatanama dan penulisan struktur berpedoman pada aturan-aturan berikut ini.
- Sistem cincin yang mengandung heteroatom dibuat sebagai induk senyawa dan cincin yang bergabung dibuat sebagai awalan.
- Bila dua atau lebih cincin mengandung heteroatom maka cincin yang mengandung N diprioritaskan sebagai induk sebelum oksigen dan belerang tetapi dalam penomoran prioritasnya tetap adalah Oksigen.
- Bila ada kemungkinan dua atau induk cincin heterosiklik maka heterosiklik paling besar adalah merupakan induk.
- Pada aturan 2 dan 3 ada kerancuan yaitu di sisi sebelah mana cincin bergabung. Untuk mengatasi maka setiap sisi cincin induk diberi notasi huruf yang dimulai dari sisi: 1 – 2 = a, 2 – 3 = b, 3 – 4 = c dan seterusnya.
- Beberapa kesempatan lain untuk penggambaran orientasi cincin polisiklik adalah sebagai berikut: Jumlah cincin terbanyak adalah arah horizontal. Bagian lain dari cincin sebelah atas diletakkan disebelah kanan dan penomoran dimulai dari puncak siklik yang sebelah kanan.
Pada
prakteknya untuk tatanama suatu senyawa heterosiklik sering dipadukan antara
tatanama secara trivial dan IUPAC. Selanjutnya akan dipelajari beberapa
golongan senyawa heterosiklik yang sering dijumpai secara alamiah, yang pada
umumnya adalah golongan heteroaromatik.








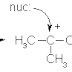
Tolong berikan contoh dari deret homolog alkana!
BalasHapusDeret homolog adalah suatu golongan/kelompok senyawa karbon dengan rumus umum yang sama, mempunyai sifat yang mirip dan antar suku-suku berturutannya mempunyai beda CH2 atau dengan kata lain merupakan rantai terbuka tanpa cabang atau dengan cabang yang nomor cabangnya sama.
HapusSifat-sifat deret homolog alkana :
o Mempunyai sifat kimia yang mirip
o Mempunyai rumus umum yang sama
o Perbedaan Mr antara 2 suku berturutannya sebesar 14
o Makin panjang rantai karbon, makin tinggi titik didihnya
Reaksi alkana A. Reaksi Oksidasi Alkana sukar dioksidasi oleh oksidator lemah atau agak kuat seperti KMNO 4 , tetapi mudah dioksidasi oleh oksigen dari udara bila dibakar. Oksidasi yang cepat dengan oksingen yang akan mengeluarkan panas dan cahaya disebut pembakaran atau combustion. Contoh : CH 4 + 2O 2 → CO 2 + 2H 2 + 212,8 kkal/mol C 4 H 10 + 2O 2 → CO 2 + H 2 O + 688,0 kkal/mol
Deret Homolog Alkana sebagai berikut:
1. CH4 = metana
2 . C2H6 = etana
3 . C3H8 = propana
4. C4H10 = butana
5. C5H12 = pentana
6. C6H14 = heksana
7. C7H16 = heptana
8. C8H18 = oktana
9. C9H20 = nonana
10. C10H22 = dekana
1.Alkana berantai lurus (tidak bercabang)
CH3-CH2-CH3 n-propana
CH3-CH2-CH2-CH3 n-butana
2. Alkana bercabang
-rantai utama( rantai C terpanjang)
Seperti yang anda katakan di postingan anda
BalasHapusKenapa Alkena atau olefin dalam kimia organik adalah hidrokarbon tak jenuh??
Alkena atau olefin dalam kimia organik adalah hidrokarbon tak jenuh dengan sebuah ikatan rangkap dua antara atom karbon. Istilah alkena dan olefin sering digunakan secara bergantian (lihat bagian Tata nama di bawah). Alkena asiklik yang paling sederhana, yang membentuk satu ikatan rangkap dan tidak berikatan dengan gugus fungsional manapun, dikenal sebagai mono-ena, membentuk suatu deret homolog hidrokarbon dengan rumus umum CnH2n. Alkena memiliki kekurangan dua atom hidrogen dibandingkan alkana terkait (dengan jumlah atom karbon yang sama). Alkena yang paling sederhana adalah etena atau etilena (C2H4) adalah senyawa organik terbesar yang diproduksi dalam skala industri. Senyawa aromatik seringkali juga digambarkan seperti alkena siklik, tetapi struktur dan ciri-ciri mereka berbeda sehingga tidak dianggap sebagai alkena.
HapusAlkena merupakan suatu senyawa hidrokarbon yang memiliki satu atau lebih ikatan rangkap dua atom karbon. Alkena mempunyai ikatan sigma dan ikatan pi antara dua atom karbon yang berhadapan. Alkena sering disebut juga olefin dan dikatakan hidrokarbon tidak jenuh karena tidak mempunyai jumlah maksimum atom yang dapat di tampung oleh tiap atom karbon.
Ikatan rangkap karbon-karbon merupakan gugus fungsional yang banyak terdapat dalam produk-produk alam dan pada umumnya ikatan rangkap ini akan bergabung dengan gugus fungsional yang lain. Selain itu alkena juga banyak ditemukan dalam komponen-komponen minyak bumi.
Alkena mempunyai sifat non polar , larut dalam air sebab mempunyai ikatan pi, dan mudah larut dalam lemak dan minyak. Alkena dapat dibuat melalui berbagai reaksi senyawa-senyawa seperti reaksi alkil halida, dehalogenasi vicinil dihalida, reaksi wittig (reaksi dengan ilid phosponium), dehidrasi alkohol, dan hidrogenasi alkuna.
Jelaskan yang dimaksud dengan Senyawa rantai tertutup ?
BalasHapusIf you're looking to lose fat then you absolutely have to try this totally brand new tailor-made keto meal plan diet.
BalasHapusTo produce this keto diet service, licensed nutritionists, fitness trainers, and cooks have united to produce keto meal plans that are effective, painless, price-efficient, and satisfying.
Since their launch in January 2019, hundreds of individuals have already completely transformed their body and well-being with the benefits a proper keto meal plan diet can offer.
Speaking of benefits: in this link, you'll discover eight scientifically-tested ones given by the keto meal plan diet.