REAKSI SUBTITUSI DAN ELIMINASI
A. Reaksi Subtitusi
reaksi subtitusi/penggantian adalah suatu atom/gugus di dalam suatu senyawa diganti oleh suatu atom/gugus lain dari
senyawa yang lain. Konsep dasarnya adalah atom/gugus yang mengganti
haruslah lebih reaktif ketimbang atom/gugus yang diganti.
Contoh:
a.
Reaksi radikal bebas alkana + uv/X2
--> Alkil halida + HX
(X
= atom halogen yaitu Cl, Br, I).
b.
Alkana + HX --> R-X + H2
(R-X
adalah senyawa alkil halida)
selain contoh di atas, dapat juga kita ketahui dengan contoh berikut:

- Reaksi monoklorinasi propana (pengantian satu atom H oleh satu atom Cl), misalnya : C3H8 + Cl2 –> C3H7Cl + HCl
- Reaksi dibrominasi propana (penggantian dua atom H oleh dua atom Br), misalnya : C3H8 + 2Br2 –> C3H6Br2 + 2HBr.
Reaksi substitusi dalam kimia organik dikelompokkan sebagai elektrofilik atau nukleofilik bergantung pada reagen yang digunakan, apakah suatu zat antara yang reaktif terlibat dalam reaksi tersebut adalah suatu karbokation, suatu karbanion atau suatu radikal bebas atau apakah substratnya merupakan suatu alifatik atau aromatik. Pemahaman mendetail mengenai jenis reaksi mampu membantu untuk memprediksi produk yang dihasilkan dari reaksi tersebut. Pemahaman ini juga berguna untuk mengoptimasi suatu reaksi dengan mempetimbangkan variabel seperti suhu dan pemilihan pelarut.
Contoh dari reaksi substitusi adalah halogenasi. Ketika gas klorin (Cl-Cl) di iradiasi, sejumlah molekul terpisah menjadi dua radikal klor (Cl.) yang elektron bebasnya merupakan nukleofil kuat. Satu atom H dalam metana (CH4) mampu digantikan dengan 1 atom Cl dalam gas klorin (Cl2) menjadi metil klorida (CH3Cl) dan asam klorida (HCl).
A. Subtitusi nukleofilik
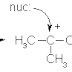
Dalam kimia organik (dan anorganik), substitusi nukleofilik adalah reaksi fundamental di mana suatu nukleofil secara selektif berikatan dengan atau menyerang muatan positif atau parsial positif pada suatu atom atau kelompok atom. Saat hal tersebut terjadi, nukleofil akan menggantikan nukleofil yang lebih lemah yang kemudian akan menjadi gugus pergi; sisa atom yang bermuatan positif atau parsial positif menjadi suatu elektrofil. Entitas molekuler keseluruhan di mana elektrofil dan gugus pergi berpisah biasanya disebut sebagai substrat.
Bentuk umum dari reaksi ini dituliskan sebagai:
- Nuc: + R-LG → R-Nuc + LG:
Contoh dari substitusi nukleofilik adalah pada hidrolisis suatu alkil bromida, R-Br, dalam kondisi basa, dimana nukleofil penyerang adalah basa OH− dan gugus perginya adalah Br−.
- R-Br + OH− → R-OH + Br−
Mekanisme
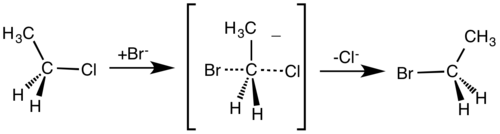
1. Mekanisme SN1Subtitusi Nukleofilik (SN 1)SN 1 ditandai dengan reaksi yang melalui jalur karbokation. Oleh karena itu, “gugus pergi “ (leaving group) haruslah terikat pada karbo tersier atau sekunder untuk menstabilkan zat intermediate nya. Dampak lain pada reaksi SN 1 memungkinkan terjadinya pergeseran hidrida dan metida.NOTE:Kekuatan Basa: Kuat-lemahnya basa tidak penting karena basa tidak terlibat dalam tahap penentu laju reaksi alias tidak memengaruhi pembentukan karbokation.Gugus pergi (Leaving groups): gugus pergi yang baik diperlukan seperti halida (-X) atau tosilat karena “gugus pergi” jelas terlibat dalam tahap pembentukan karbokationHati-hati terhadap reaksi penataan ulang (baik geseran hidrida maupun metida) pada jalur SN1 karena ingat di sini terjadi pembentukan karbokation sebagai zat intermediatnya. Cermati mekanisme jalur SN1 secara umum sbb:
Perhatikan contoh reaksi SN 1 sbb:

Mekanisme SN1 memiliki dua tahapan reaksi. Pada tahap pertama, gugus pergi terlepas, membentuk suatu karbokation C+. Dalam tahapan kedua, reagen nukleofilik (Nuc:) menempel pada karbokation dan membentuk suatu ikatan kovalen sigma. Jika substrat memiliki karbon kiral, mekanisme ini dapat menghasilkan baik berupa inversi stereokimia atau retensi konfigurasi. Biasanya keduanya dihasilkan tanpa arahan. Produk utamanya adalah rasemat.
Sebagai contoh mekanisme reaksi ini adalah pada reaksi tert-butil bromida dengan air (lihat pada reaksi SN1).
Gambar : Mekanisme SN1 pada karbon kiral 2. Mekanisme SN2
Cermati bentuk umum mekanisme SN2: nuc: = nucleophileX = leaving group (usually halide or tosylate)Pada reaksi SN2, “gugus pergi” (gugus umum yang biasa adalah halida atau tosilat) diganti dengan suatu nukelofil. Reaksi ini bekerja paling baik pada metil dan halida primer karena alkil halida yang mengandung banyak cabang dapat menghalangi serangan Nukelofil dari belakang. Pada halida sekunder dan tersier reaksi SN2 sulit terjadi.
nuc: = nucleophileX = leaving group (usually halide or tosylate)Pada reaksi SN2, “gugus pergi” (gugus umum yang biasa adalah halida atau tosilat) diganti dengan suatu nukelofil. Reaksi ini bekerja paling baik pada metil dan halida primer karena alkil halida yang mengandung banyak cabang dapat menghalangi serangan Nukelofil dari belakang. Pada halida sekunder dan tersier reaksi SN2 sulit terjadi.
Perhatikan contoh ion hidroksida sebagai Nukleofil dan Bromine sebagai “gugus pergi” yang baik:

 NOTE:-SN2 cenderung untuk mengalami inversi konfigurasi disebabkan serangan Nukleofil dari arah belakang.Pelarut protik seperti air dan alkohol menstabilkan Nukleofil yang tidak bereaksi sekalipun. Oleh karena itu pelarut polar yang aprotik misalnya eter, keton, hidrokarbon tersubstitusi halogen juga diperlukan.Nukleofil yang baik diperlukan karena keadaan ini terlibat dalam tahap penentu laju reaksi.Gugus pergi yang baik seperti halida atau tosilat diperlukan pada tahap penentu laju reaksi.
NOTE:-SN2 cenderung untuk mengalami inversi konfigurasi disebabkan serangan Nukleofil dari arah belakang.Pelarut protik seperti air dan alkohol menstabilkan Nukleofil yang tidak bereaksi sekalipun. Oleh karena itu pelarut polar yang aprotik misalnya eter, keton, hidrokarbon tersubstitusi halogen juga diperlukan.Nukleofil yang baik diperlukan karena keadaan ini terlibat dalam tahap penentu laju reaksi.Gugus pergi yang baik seperti halida atau tosilat diperlukan pada tahap penentu laju reaksi.
Mekanisme SN2 hanya memiliki satu tahapan reaksi. Penyerangan reagen dan pelepasan gugus pergi terjadi secara bersamaan. Mekanisme ini selalu menghasilkan inversi konfigurasi.
Jika substrat yang merupakan target penyerangan nukleofil bersifat kiral, reaksi akan mengarah pada inversi stereokimia yang disebut sebagai inversi Walden.
Sebagai contoh mekanisme reaksi ini adalah pada reaksi kloroetana dengan ion bromida (lihat pada reaksi SN2).
Mekanisme SN2
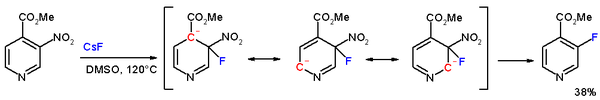
Jika substrat adalah suatu senyawa aromatik jenis reaksi yang terjadi adalah substitusi nukleofilik aromatik. Turunan asam karboksilat bereaksi dengan nukleofil dalam substitusi nukleofilik asil. Jenis reaksi tersebut dapat berguna dalam preparasi senyawa.
gambar : Substitusi nukleofilik aromatik pada piridina gambar : Substitusi nukleofilik asil b. Substitusi elektrofilik
Substitusi elektrofilik adalah reaksi fundamental di mana melibatkan suatu elektrofil, khususnya dalam substitusi elektrofilik aromatik.
Dalam contoh berikut struktur resonansi elektron pada cincin benzena diserang oleh suatu elektrofil E+. Ikatan resonansi rusak dan suatu struktur karbokation beresonansi terbentuk. Akhirnya suatu proton terlepas dan suatu senyawa aromatik baru terbentuk.
Reaksi elektrofilik pada senyawa tak jenuh lainnya selain arena secara umum mengarah pada adisi elektrofilik daripada substitusi.
c. Substitusi radikal
Suatu reaksi substitusi radikal melibatkan radikal bebas. Sebagai contoh adalah pada reaksi Hunsdiecker.
d. Substitusi organologam
Reaksi penggandengan adalah suatu jenis reaksi yang dikatalisis oleh logam yang melibatkan suatu senyawa organologam RM dan suatu halida organik R'X yang bersama-sama bereaksi membetuk suatu senyawa dengan rumus kimia R-R' dengan pembentukan suatu ikatan karbon-karbon yang baru. Contoh reaksi ini adalah reaksi Suzuki.
Senyawa tersubstitusi
Sebagai contoh, benzena adalah suatu cincin aromatik sederhana. Benzena yang telah tersubsitusi merupakan suatu kelompok senyawa kimia heterogen dengan sifat dan kegunaan yang luas:
Contoh senyawa benzena tersubstitusi Senyawa Rumus kimia Struktur Benzena C6H6 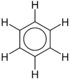
Toluena C6H5-CH3 
o-Xilena C6H4(-CH3)2 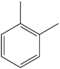
Mesitilena C6H3(-CH3)3 
Fenol C6H5-OH 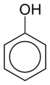 B. Reaksi EliminasiMerupakan reaksi kebalikan dari reaksi adisi. Reaksi yang mengubah ikatan sigma menjadi ikatan phi.=berlaku eliminasi beta.Contoh:a. R-OH + H2SO4/110o C --> alkena + H2OIngat bahwa alkena merupakan produk utama sedangkan H2O adalah produk samping.Seringkali dalam reaksi kimia organik, produk samping tidak ditulis. Kendati demikian agar anda dapat membuat reaksi kimia menjadi setara koefisien reaksi maka semua produk samping yang dihasilkan perlu ditulis.b. R- X + NaOH/etanol --> alkena + Na-X + H2OBerlaku untuk hal yang sama pada reaksi sebelumnya bahwa, Na-X dan H2O adalah produk samping. Sedangkan Alkena merupakan produk mayor sekaligus produk utamanya.Eliminasi artinya pelepasan atau penghilangan. Reaksi eliminasi dapat dianggap kebalikan dari reaksi adisi. Pada reaksi ini, dua atom atau gugus yang masing-masing terikat pada dua buah atom C yang letaknya berdampingan dilepaskan oleh suatu pereaksi sehingga menghasilkan ikatan rangkap. Reaksi ini hanya dapat berlangsung bila ada zat yang menarik molekul yang akan dieliminasi. Reaksi eliminasi digunakan untuk membuat senyawa-senyawa alkena dan alkuna. Sebaga contoh adalah reaksi pembuatan etena dari etanol.Reaksi Eliminasi adalah suatu jenis reaksi organik dimana dua substituen dilepaskan dari sebuah molekul baik dalam satu atau dua langkah mekanisme, atau dapat disebut juga penyingkiran atau penghilangan beberapa atom yang terjadi pada suatu senyawa. Pada reaksi ini senyawa yang berikatan tunggal berubah menjadi ikatan rangkap.Reaksi satu langkah disebut dengan reaksi E2. Sedangkan reaksi dua langkah disebut dengan reaksi E1. Harap diingat bahwa symbol angka pada huruf E (yang berarti elimination) tidak melambangkan jumlah langkah. E2 dan E1 menyatakan kinetika reaksi, yaitu berturut-turut bimolekuler dan unimolekuler.
B. Reaksi EliminasiMerupakan reaksi kebalikan dari reaksi adisi. Reaksi yang mengubah ikatan sigma menjadi ikatan phi.=berlaku eliminasi beta.Contoh:a. R-OH + H2SO4/110o C --> alkena + H2OIngat bahwa alkena merupakan produk utama sedangkan H2O adalah produk samping.Seringkali dalam reaksi kimia organik, produk samping tidak ditulis. Kendati demikian agar anda dapat membuat reaksi kimia menjadi setara koefisien reaksi maka semua produk samping yang dihasilkan perlu ditulis.b. R- X + NaOH/etanol --> alkena + Na-X + H2OBerlaku untuk hal yang sama pada reaksi sebelumnya bahwa, Na-X dan H2O adalah produk samping. Sedangkan Alkena merupakan produk mayor sekaligus produk utamanya.Eliminasi artinya pelepasan atau penghilangan. Reaksi eliminasi dapat dianggap kebalikan dari reaksi adisi. Pada reaksi ini, dua atom atau gugus yang masing-masing terikat pada dua buah atom C yang letaknya berdampingan dilepaskan oleh suatu pereaksi sehingga menghasilkan ikatan rangkap. Reaksi ini hanya dapat berlangsung bila ada zat yang menarik molekul yang akan dieliminasi. Reaksi eliminasi digunakan untuk membuat senyawa-senyawa alkena dan alkuna. Sebaga contoh adalah reaksi pembuatan etena dari etanol.Reaksi Eliminasi adalah suatu jenis reaksi organik dimana dua substituen dilepaskan dari sebuah molekul baik dalam satu atau dua langkah mekanisme, atau dapat disebut juga penyingkiran atau penghilangan beberapa atom yang terjadi pada suatu senyawa. Pada reaksi ini senyawa yang berikatan tunggal berubah menjadi ikatan rangkap.Reaksi satu langkah disebut dengan reaksi E2. Sedangkan reaksi dua langkah disebut dengan reaksi E1. Harap diingat bahwa symbol angka pada huruf E (yang berarti elimination) tidak melambangkan jumlah langkah. E2 dan E1 menyatakan kinetika reaksi, yaitu berturut-turut bimolekuler dan unimolekuler.
Reaksi E1Reaksi E1 adalah reaksi eliminasi dimana suatu karbokation (suatu zat antara yang tak stabil dan berenergi tinggi, yang dengan segera bereaksi lebih lanjut) dapat memberikan sebuah proton kepada suatu basa dan menghasilkan sebuah alkena. Pada reaksi SN1, salah satu cara karbokation mencapai produk yang stabil ialah dengan bereaksi dengan sebuah nukleofil.Karbokation adalah suatu zat antara yang tak stabil dan berenergi tinggi. Karbokation memberikan kepada basa sebuah proton dalam reaksi eliminasi, dalam hal ini reaksi E1 menjadi sebuah alkena.Mekanisme E1Tahap 1 (lambat)Pertama dalam reaksi eliminasi adalah tahap lambat dan merupakan tahap penentu laju dari reaksi keseluruhan. Suatu reaksi E1 yang khas menunjukkan kinetika order-pertama, dengan laju reaksi hanya bergantung pada konsentrasi alkil halide saja.Tahap 2 (cepat)Dalam tahap dua reaksi eliminasi, basa itu merebut sebuah proton dari sebuah atom karbon yang terletak berdampingan dengan karbon positif. Elektron ikatan sigma karbon hidrogen bergeser ke arah muatan positif, karbon itu mengalamiRehibridisasi dari keadaan sp3 ke keadaan sp2, dan terbentuklah alkena.Karena suatu reaksi E1 berlangsung lewat zat antara karbokation, maka tidak mengherankan bahwa alkil halida tersier lebih cepat daripada alkil halida lain.REAKSI E2Reaksi E2 (eliminasi bimolekular) ialah reaksi eliminasi alkil halida yang paling berguna. Reaksi E2 alkil halida cenderung dominan bila digunakan basa kuat, seperti –OH dan –OR, dan temperatur tinggi. Secara khas reaksi E2 dilaksanakan dengan memanaskan alkil halida dengan K+ -OH / Na+ -OCH2CH3 dalam etanol.Reaksi E2 berjalan tidak lewat suatu karbokation sebagai zat-antara, melainkan berupa reaksi serempak (concerted reaction) yakni terjadi pada satu tahap, sama seperti reaksi SN2. - Basa membentuk ikatan dengan hidrogen
- Elektron-elektron C-H membentuk ikatan pi
- Brom bersama sepasang elektronnya meninggalkan ikatan sigma C-Br.
Persamaan diatas menunjukkan mekanisme,
dengan anak panah bengkok menyatakan “pendorongan elektron” (electron-pushing).
Dalam reaksi E2, seperti dalam reaksi E1,
alkil halida tersier bereaksi paling cepat dan alkil halida primer paling
lambat. (Bila diolah dengan suatu basa, alkil halide primer biasanya begitu
mudah bereaksi substitusi, sehingga sedikit alkena terbentuk)
Perbedaan antara mekanisme eliminasi E1 dan E2
E1
E1
terjadi pada:
terjadi pada:
Perbedaan antara mekanisme eliminasi E1 dan E2
E1
1.
membentuk
karbokation
2.
karbokation
memberi proton pada basa lalu terbentuk alkena
3.
basa merebut
proton dari atom C (beta, C yang berdampingan dengan C+)
E2
1.
nukleofil
langsung mengambil proton dari atom C (beta) pada atom C gugus pergi
2.
tidak terjadi
pembentukan karbokation
3.
pembentukan
secara serempak
Perbandingan E1 dan E2E1
terjadi pada:
1.
konsentrasi
basa rendah
2.
dengan
pelarut basa
3.
dengan
substrat tersier dan beresonansi (alkil halida)
E2 terjadi pada:
1.
pada basa
kuat dengan konsentrasi tinggi
·
Alkil
halida+basa kuat+panas à E2
·
Alkil
halida+asam kuat+panas àE1
·
Alkohol+asam
kuat+panas à E1







Apa itu nukleofil dalam substistusi nukleofilik?
BalasHapusPenyerangan pada SN2 dapat terjadi jika rute sisi belakang penyerangan tidak terdapat halangan sterik oleh substituen atau substrat.ala yang terjadi apabila terdapat halangan sterik pada SN2?
BalasHapusapa yang menyebabkan Reaksi E2 alkil halida cenderung dominan bila digunakan basa kuat?
BalasHapusBagaimana mekanisme reaksi substitusi elektrofilik pada cincin aromatik?
BalasHapusIf you're trying hard to lose weight then you certainly need to start following this totally brand new tailor-made keto meal plan diet.
BalasHapusTo create this keto diet service, licensed nutritionists, personal trainers, and top chefs joined together to develop keto meal plans that are productive, decent, economically-efficient, and satisfying.
Since their first launch in 2019, 100's of clients have already transformed their body and well-being with the benefits a good keto meal plan diet can provide.
Speaking of benefits; clicking this link, you'll discover 8 scientifically-certified ones provided by the keto meal plan diet.