PENGERTIAN REAKSI RADIKAL BEBAS
Radikal bebas adalah atom atau molekul bermuatan listrik atau netral
yang memiliki satu atau lebih elektron yang tidak berpasangan di orbital
terluar mereka. Radikal bebas tidak stabil dan bereaksi cepat dengan
atom dan molekul lainnya sehingga dapat menyebabkan kerusakan pada
jaringan. Radikal bebas dapat dihasilkan dari hasil metabolisme tubuh dan faktor
eksternal seperti hasil penyinaran ultra violet, zat kimiawi dalam
makanan dan polutan lain. Penyakit yang disebabkan oleh radikal bebas
bersifat kronis, yaitu dibutuhkan waktu bertahun-tahun untuk penyakit
tersebut menjadi nyata. Radikal bebas yang mengambil elektron dari sel
tubuh manusia dapat menyebabkan perubahan struktur DNA sehingga
menimbulkan sel-sel mutan. Tubuh manusia, sebenarnya dapat menghasilkan
antioksidan tetapi jumlahnya sering sekali tidak cukup untuk menetralkan
radikal bebas yang masuk ke dalam tubuh. Antioksidan adalah zat yang membantu untuk membatasi kerusakan
dari elektron tidak berpasangan ini.. Ketidakseimbangan antara radikal bebas dengan antioksidan menyebabkan
terjadinya suatu keadaan yang disebut stress oksidatif. Stress oksidatif
adalah suatu keadaan dimana tingkat kelompok oksigen reaktif (ROS) yang
toksik melebihi pertahanan atioksidan endogen. Keadaan ini
mengakibatkan kelebihan radikal bebas yang akan bereaksi dengan lemak,
protein, dan asam nukleat seluler sehingga terjadi kerusakan lokal dan
disfungsi organ tertentu .
Antioksidan adalah substansi yang diperlukan tubuh untuk menetralisir
radikal bebas dan mencegah kerusakan yang ditimbulkan oleh radikal bebas
terhadap sel normal, protein, dan lemak. Antioksidan menstabilkan
radikal bebas dengan melengkapi kekurangan elektron yang dimiliki
radikal bebas, dan menghambat terjadinya reaksi berantai dari
pembentukan radikal bebas yang dapat menimbulkan stres oksidatif.
Antioksidan yang dikenal ada yang berupa enzim dan ada yang berupa
mikronutrien. Enzim antioksidan dibentuk dalam tubuh, yaitu super oksida
dismutase

(SOD), glutation peroksida, katalase, dan glutation reduktase.
Antioksidan yang berupa mikronutrien dikenal tiga yang utama, yaitu :
b-karoten, vitamin C dan vitamin E. B-caroten merupakan scavengers
(pemulung) oksigen tunggal, vitamin C merupakan pemulung superoksida dan
radikal bebas yang lain, sedangkan vitamin E merupakan pemutus rantai
peroksida lemak pada membran dan Low Density Lipoprotein. Vitamin E yang
larut dalam lemak merupakan antioksidan yang melindungi Poly
Unsaturated Faty Acids (PUFAs) dan komponen sel serta membran sel dari
oksidasi oleh radikal bebas.
Antioksidan sekunder, mampu mendekomposisi hidroperoksida menjadi bentuk
stabil, pada manusia dikenal SOD, katalase, glutation peroksidase.
Mekanisme kerja antioksidan seluler adalah berinteraksi langsung dengan
oksidan, radikal bebas atau oksigen tunggal, mencegah pembentukan jenis
oksigen reaktif, mengubah jenis oksigen reaktif menjadi kurang toksik,
mencegah kemampuan oksigen reaktif, memperbaiki kerusakan yang timbul.Radikal bebas ini merupakan spesies yang sangat reaktif sehingga umurnya pendek. Radikal bebas dibentuk jika ikatan terbelah menjadi dua yang sama-sehingga setiap atom mendapat satu dari dua elektron yang dipakai untuk berikatan.
Reaksi ini tapi terbagi menjadi 3 tahap; yaitu inisiasi,
progasi, dan terminasi.
Tahap ini adalah tahap untuk pemaksapisahan (cleavage)
homolitik molekul Cl2 dengan bantuan panas dan uv menjadi 2 radial bebas klor.
Cl2 → Cl• + Cl•
Tahap inisiasi merupakan tahap awal pembentukan radika-radikal bebas
dengan pembelahan homolitik sehingga nasing-masing atom terpisah dengan
membawa satu elektron. Terlepas dari itu, inisiasi dapat terbentuk
secara sepontan atau karena pengaruh panas/cahaya. Selain itu juga
radikal bebas dapat terbentuk melalui transfer satu elektron (dengan
melepas dan menerima elektron).
2. Propagasi
Tahap ini adalah tahap untuk membuat suatu senyawa atau
unsur menjadi radikal dengan mereaksikannya dengan suatu
radikal. Setelah terbentuk radikal bebas dengan kereaktifan yang tinggi yang
kemudian dapat bereaksi dengan setiap spesies yang ditemukan. Pada tahap
ini akan terbentuk radikal bebas yang baru, karena radikal bebas yang
dihasilkan pada tahap awal bereaksi dengan molekul lain. Selanjutnya
radikal bebas baru tersebut dapat pula bereaksi dengan molekul atau
radikal bebas yang lain. Oleh karena itu dalam proses propagasi
dikatakan terjadi reaksi berantai. Apabila radikal bebasnya sangat
reaktif, misalnya radikal alkil, maka terjadi rantai yang panjang karena
melibatkan sejumlah besar molekul. Apabila radikal bebasnya
kereaktifannya rendah, misalnya radikal aril, maka kemampuannya bereaksi
rendah sekali, sehingga rantai yang terjadi pendek, bahkan mungkin
tidak terjadi rantai.
Tahap ini adalah tahap untuk menghilangan atau mengubah
radikal bebas menjadi radikal bebas stabil dan tidak reaktif.
Langkah berikutnya adalah destruksi radikal bebas atau langkah terminasi, yang ditandai oleh kombinasi radikal bebas yang sama ataupun yang berbeda,dan langkah ini mengakhiri reaksi radikal bebas.
Reaksi Substitusi Radikal Bebas pada Senyawa Alifatik
Hubungan antara struktur substrat dan kereaktifannya dalam reaksi radikal bebas adalah
1. Pada alkana
Kereaktifan H30 > H20 > H10 (H30 : H tersier dan seterusnya)
2. Atom H alilik dapat dobrominasi dengan pereaksi NBS
3. Atom H tersier mudah dioksidasi
a. Halogenasi pada atom C gugus alkil
Alkana dapat diklorinasi atau dibrominasi dengan mereaksikannnya pada klor atau brom dibawah pengaruh cahaya tampak atau cahaya ultraviolet.
Contoh:
b. Halogenasi Alilik
Alkena dapat dihalogenasi pada posisi alilik dengan menggunakan sejumlah pereaksi seperti N-bromosuksinimida (disingkat NBS) dengan rumus struktur adalah sebagai berikut:
│ │ │ peroksida │ │ │
Reaksi : - C = C – C – H + NBS - C = C – C – Br
│ CCl4 │
Brominasi yang menggunakan NBS dengan pelarut nonpolar CCl4 dinamakan reaksi Wohl-Ziegler. Dalam reaksi ini diperlukan inisiator senyawa peroksida, atau cahaya ultraviolet. Pereksi NBS dapat pula digunakan untuk melakukan brominasi pada: posisi- terhadap gugus karbonil, ikatan ganda-tiga, dan cincin aromatik. bila pada suatu senyawa terdapat ikatan rangkap dan ikatan ganda-tiga, maka yang diserang adalah poisisi- terhadap ikatan ganda-tiga. Dauber dan McCoy menyimpulkan bahwa mekanisme brominasi alilik merupakan mekanisme radikal bebas. Reaksi ini tidak akan berlangsung tanpa inisiator, yang berupa Br•. Diungkapkan pula bahwa yang mengabstraksi atom H dalam substrat adalah atom Br. Setelah terjadi tahap inisiasi yang mengahasilkan Br•, maka langkah-langkah dalam tahap propagasinya adalah :
(1) Br • + RH → R • + HBr
(2) R• + Br2 → RBr + Br
Penghasil Br2 dalam reaksi ini adalah reaksi antara NBS dan HBr yang dihasilkan dari persamaan reaksi (1) diatas.
Dengan demikian fungsi NBS adalah sebagai sumber brom dengan konsentrasi yang rendah dan mengikat HBr yang dibebaskan dari persamaan reaksi (1).
c. Hidroksilasi pada atom C alifatik
Senyawa alkohol dapat dihasilkan dari reaksi oksidasi senyawa-senyawa yang mengndung ikatan -C-H. Karena pada umumnya ikatan –C–H tersebut merupakan C tersier maka alkohol yang diperoleh adalah suatu alkohol tersier. Hal disebabkan karena ikatan -C–H tersier memang lebih mudah diserang radikal bebas daripada ikatan C-H primer dan sekunder. Dalam pembentukan alkohol tersier ini, hasil yang terbaik dapat dicapai dengan menggunakan O3 dan substratnya diserapkan pada silika gel.
O3
Reaksi: R3CH R3COH
Silika gel
Langkah berikutnya adalah destruksi radikal bebas atau langkah terminasi, yang ditandai oleh kombinasi radikal bebas yang sama ataupun yang berbeda,dan langkah ini mengakhiri reaksi radikal bebas.
Reaksi Substitusi Radikal Bebas pada Senyawa Alifatik
Hubungan antara struktur substrat dan kereaktifannya dalam reaksi radikal bebas adalah
1. Pada alkana
Kereaktifan H30 > H20 > H10 (H30 : H tersier dan seterusnya)
2. Atom H alilik dapat dobrominasi dengan pereaksi NBS
3. Atom H tersier mudah dioksidasi
a. Halogenasi pada atom C gugus alkil
Alkana dapat diklorinasi atau dibrominasi dengan mereaksikannnya pada klor atau brom dibawah pengaruh cahaya tampak atau cahaya ultraviolet.
Contoh:
b. Halogenasi Alilik
Alkena dapat dihalogenasi pada posisi alilik dengan menggunakan sejumlah pereaksi seperti N-bromosuksinimida (disingkat NBS) dengan rumus struktur adalah sebagai berikut:
│ │ │ peroksida │ │ │
Reaksi : - C = C – C – H + NBS - C = C – C – Br
│ CCl4 │
Brominasi yang menggunakan NBS dengan pelarut nonpolar CCl4 dinamakan reaksi Wohl-Ziegler. Dalam reaksi ini diperlukan inisiator senyawa peroksida, atau cahaya ultraviolet. Pereksi NBS dapat pula digunakan untuk melakukan brominasi pada: posisi- terhadap gugus karbonil, ikatan ganda-tiga, dan cincin aromatik. bila pada suatu senyawa terdapat ikatan rangkap dan ikatan ganda-tiga, maka yang diserang adalah poisisi- terhadap ikatan ganda-tiga. Dauber dan McCoy menyimpulkan bahwa mekanisme brominasi alilik merupakan mekanisme radikal bebas. Reaksi ini tidak akan berlangsung tanpa inisiator, yang berupa Br•. Diungkapkan pula bahwa yang mengabstraksi atom H dalam substrat adalah atom Br. Setelah terjadi tahap inisiasi yang mengahasilkan Br•, maka langkah-langkah dalam tahap propagasinya adalah :
(1) Br • + RH → R • + HBr
(2) R• + Br2 → RBr + Br
Penghasil Br2 dalam reaksi ini adalah reaksi antara NBS dan HBr yang dihasilkan dari persamaan reaksi (1) diatas.
Dengan demikian fungsi NBS adalah sebagai sumber brom dengan konsentrasi yang rendah dan mengikat HBr yang dibebaskan dari persamaan reaksi (1).
c. Hidroksilasi pada atom C alifatik
Senyawa alkohol dapat dihasilkan dari reaksi oksidasi senyawa-senyawa yang mengndung ikatan -C-H. Karena pada umumnya ikatan –C–H tersebut merupakan C tersier maka alkohol yang diperoleh adalah suatu alkohol tersier. Hal disebabkan karena ikatan -C–H tersier memang lebih mudah diserang radikal bebas daripada ikatan C-H primer dan sekunder. Dalam pembentukan alkohol tersier ini, hasil yang terbaik dapat dicapai dengan menggunakan O3 dan substratnya diserapkan pada silika gel.
O3
Reaksi: R3CH R3COH
Silika gel
Ada dua cara yang digunakan untuk menulis rumus radikal
bebas, yaitu:
a. Dengan cara rumus lewis, yakni dengan
menggambarkan semua elektron pada atom, baik yang berpasangan maupun tidak
dengan lambang berupa titik.
b. Dengan hanya menuliskan elektron yang tidak
berpasangan dengan lambang titik. lambang ini lazim di pakai pada penulisan
reaksi radikal bebas
contoh: Cl• , RO•, RN•
contoh: Cl• , RO•, RN•
Sumber radikal bebas terbagi menjadi
2 macam,yaitu endogenus dan eksogenus yangterjadi melalui sederetan mekanisme reaksi.
Radikal bebas endogenus merupakan radikal bebas yang di hasilkan
dari proses metabolisme tubuh, sedangkan sumber radikal bebaseksogenus merupakan radikal bebas yang di hasilkan
dari luar tubuh seperti asap rokok, beberapa logam, hasil penyinaran
ultra violet, radiasi, zat kimiawi dalam makanan dan polutan lain.
Misalnya pada molekul air, ikatan atom oksigen dengan atom hidrogen berupa ikatan
kovalen.
Atom Hidrogen : •H
Atom Oksigen : •O•
H2O
: H꞉Ō̲꞉H H─O─H
Bila terdapat sumber energi yang
cukup besar, misalnya karena radiasi, molekul air dapat mengalami
pembelahan homolitik
- Mekanisme Kerja
Mekanisme terbentuknya radikal bebas dapat dimulai oleh banyak hal,
baik yang bersifat endogen maupun eksogen. Reaksi selanjutnya adalah
peroksidasi lipid membran dan sitosol yang mengakibatkan terjadinya
serangkaian reduksi asam lemak sehingga terjadi kerusakan membran dan
organel sel.
Peroksidasi (otooksidasi) lipid bertanggung jawab tidak hanya pada
kerusakan makanan, tapi juga menyebabkan kerusakan jaringan in vivo
karena dapat menyebabkan kanker, penyakit inflamasi, aterosklerosis, dan
penuaan. Efek merusak tersebut akibat produksi radikal bebas (ROO•,
RO•, OH•) pada proses pembentukan peroksida dari asam lemak. Peroksidasi
lipid merupakan reaksi berantai yang memberikan pasokan radikal bebas
secara terus-menerus yang menginisiasi peroksidasi lebih lanjut.
- Tipe radikal bebas dalam tubuh
Radikal bebas terpenting dalam tubuh adalah radikal derivat dari oksigen yang disebut kelompok oksigen reaktif (reactive oxygen species/ROS), termasuk didalamnya adalah triplet (3O2), tunggal (singlet/1O2), anion superoksida (O2.-), radikal hidroksil (-OH), nitrit oksida (NO-), peroksinitrit (ONOO-), asam hipoklorus (HOCl), hidrogen peroksida (H2O2), radikal alkoxyl (LO-), dan radikal peroksil (LO-2).
Radikal bebas yang mengandung karbon (CCL3-)
yang berasal dari oksidasi radikal molekul organik. Radikal yang
mengandung hidrogen hasil dari penyerangan atom H (H-). Bentuk lain
adalah radikal yang mengandung sulfur yang diproduksi pada oksidasi
glutation menghasilkan radikal thiyl (R-S-). Radikal yang mengandung
nitrogen juga ditemukan, misalnya radikal fenyldiazine.
A. pembentukan radikal bebas
Radikal bebas adalah molekul yang
mempunyai electron tidak berpasangan dan diberi symbol titik : R·.
Berdasarkan definisi tersebut maka atom hidrogen, sebagian mineral
transisi dan molekul oksigen adalah termasuk radikal bebas. Pada
makhluk hidup radikal bebas terbentuk pada mitokondria, mikrosom,
peroksisom melalui rangkaian reaksi enzimatik yang normal berlangsung
dalam metabolisme (enzim-enzim oksidase, hidroperoksidase, dan
oksigenase) atau pengaruh eksternal seperti asap rokok, radiasi
ionisasi dan obat-obatan.
Pada manusia radikal bebas
paling banyak adalah radikal bebas oksigen sebagai hasil sampingan dari
rantai pernafasan di mitokondira. Radikal bebas yang terbentuk yaitu
O2– (radikal peroksida) dan –OH (radikal hidroksil). Radikal bebas yang
terbentuk di dalam tubuh secara normal dapat dinetralisir oleh
mekanisme pertahanan yang meliputi sistem enzimatik dan substansi
tertentu. Apabila radikal bebas tidak diredam oleh pertahanan tubuh,
maka radikal bebas yang bersifat sangat reaktif akan merusak beberapa
komponen sel seperti protein, lipid, karbohidrat dan nukleotida serta
makromolekul jaringan ikat. Asam lemak tidak jenuh merupakan komponen
sel yang paling peka terhadap radikal bebas dan akan membentuk reaksi
rantai peroksida lipid (Harman, 1998).
Pada tahap awal reaksi peroksidasi lipid, radikal bebas akan bereaksi dengan hidrogen dari asam lemak tak jenuh (RH) membentuk radikal bebas lipid (R·)(1). dalam suasana aerob maka radikal bebas lipid (R·) akan bereaksi dengan oksigen (O2) membentuk radikal peroksil lipid (ROO·) (2) dan selanjutnya bereaksi membentuk hidroperoksid lipid (ROOH) dan juga radikal bebas lipid (3) (Slater, 1994).
(RH) ––––––> (R) (1)
(R·) + (O2) ––––––> (ROO·) (2)
(ROO·) + RH ––––––> ROOH + (R·)
Reaksi ini dapat berlangsung terus-menerus membentuk reaksi rantai dan menyebabkan membran sel kehilangan asam lemak tak jenuh. Hilangnya asam lemak tak jenuh akan menyebabkan kerusakan struktur sel membran yang akan mempengaruhi permeabilitas dan fungsi membran sel. Reaksi rantai peroksidasi lipid yang berlangsung terus akan menyebabkan membran sel kehilangan integritas sehingga akhirnya pecah. Apabila kerusakan mengenai membran lisosom, maka enzim hidrolitik akan dilepas sehingga merusak organel lain dan memperberat kerusakan sel (Slater, 1994).
Hidroperoksida lipid yang terbentuk pada reaksi peroksidasi lipid akan bereaksi dengan trace mineral seperti zat besi, yang ada di kedua sisi membran sel dan membentuk radikal alkoksi (R–O·) dan radikal peroksi (R–OO·). Kedua radikal bebas tersebut selanjutnya menstimulasi terjadinya reaksi rantai peroksidasi lipid lebih banyak sehingga akan memperberat kerusakan membran sel. Di samping itu kedua radikal bebas juga akan mengalami degradasi sehingga menghasilkan pentana, etana, dan aldehid. Salah satu aldehid yang terbentuk yaitu malonaldehid selanjutnya akan bereaksi dengan protein yang ada dalam membran, fosfolipid dan asam nukleat membentuk cross-linking dan agregasi protein membran. Produk kondensasi malonaldehid dengan protein, fosfolipid dan asam nukleat mempunyai sifat berfluoresensi. Akumulasi produk ini disebut pigmen menua (aging pigment), lipofusin atau seroid. Peroksidasi dari organel sel (lisosom, makrosom atau mitokondria) juga menghasilkan produk yang mempunyai sifat berfluoresensi seperti lipofusin. Pada keadaan normal lisosom berfungsi untuk menghidrolisa bahan-bahan intraselular melalu proses endositosis. Apabila membran lisosom rusak oleh karena reaksi peroksidasi lipid maka lisosom akan terisi oleh bahan-bahan intrasel yang tidak dapat dimetabolisme sehingga membetuk pigmen menua atau lipofusin. Pigmen menua atau lipofusin yang terbentuk dapat menyebabkan sel kehilangan integritas dan fungsinya (Halliwell dan Gutteridge, 1994).
Banyaknya jumlah sel yang rusak atau mati serta tertimbunnya produk cross-linking dan pigmen menua (aging pigmen), merupakan perubahan yang akan mengakibatkan kegagalan fungsi organ yang mempunyai peranan dalam menginisiasi atau mempercepat proses menua. Bila terjadi pada banyak sel dan terdapat di dalam organ-organ vital seperti jantung atau otak maka keadaan ini akan menyebabkan individu tersebut mati.
B. Sumber-sumber Radikal Bebas
Inisiator adalah zat yang dalam kondisi reaksi tertentu dapat menghasilkan sejumlah radikal bebas yang memungkinkan reaksi radikal bebas berlanjut. Berikut disajikan beberapa senyawa yang dapat menghasilkan radikal bebas.
a. Halogen (Cl2, Br2, F2, dan seterusnya)
contoh:
b. Peroksida (HOOH, atau ROOR)
Contoh:
c. Senyawa azo (RNNR)
Contoh:
d. alkil halida (R-X)
e. hipoklorit (R-O-Cl)
C. Struktur kimia radikal bebas
Radikal bebas dapat terbentuk in-vivo dan in-vitro secara :
1. Pemecahan satu molekul normal secara homolitik menjadi dua. Proses ini jarang terjadi pada sistem biologi karena memerlukan tenaga yang tinggi dari sinar ultraviolet, panas, dan radiasi ion.
2. Kehilangan satu elektron dari molekul normal
3. Penambahan elektron pada molekul normal
Pada radikal bebas elektron yang tidak berpasangan tidak mempengaruhi muatan elektrik dari molekulnya, dapat bermuatan positif, negatif, atau netral.
D. Kereaktifitasan radikal bebas
Radikal bebas merupakan senyawa yang terkenal sangat reaktif karena mempunyai elektron menyendiri atau tak berpasangan. Intermediet radikal alkil distbilkan oleh proses fisika yang hampir sama dengan karbokation. Semakin tinggi tingkat subsitusi alkil, maka stabilitas radikal alkil juga semakin tinggi. Dengan demikian, pembentukan radikal tersier (R3C·) lebih mudah daripada radikal sekunder (R2HC·), dan jauh lebih mudah daripada radikal primer (RH2C·). Maka radikal yang terletak di sisi gugus fungsi seperti karbonil, nitril, dan eter akan lebih stabil daripada radikal alkil tersier.
Radikal dapat menyerang ikatan rangkap. Walaupun demikian, tidak seperti ion yang serupa, beberapa reaksi radikal tidak dilangsungkan oleh interaksi elektrostatik. Sebagai contoh, reaktivitas ion nukleofilik dengan senyawa α,β-tak jenuh (C=C–C=O) dilangsungkan oleh penarikan elektron oksigen, yang menghasilkan muatan positif parsial pada karbon karbonil. Ada dua buah reaksi yang teramati pada kasus ionik. Yang pertama karbonil diserang dalam adisi langsung pada karbonil atau gugus vinil diserang langsung dalam adisi konjugasi. Yang kedua, muatan nukleofil diambil oleh oksigen. Radikal mengadisi secara cepat ikatan rangkap, dan menghasilkan karbonil α-radikal yang relatif stabil.
Pada reaksi intramolekular, kendali yang tepat dapat dicapai untuk menghindari reaktivitas radikal yang ekstrim.
Home » Kimia Organik » Radikal Bebas » Stabilitas Radikal Bebas
E. Stabilitas radikal bebas
Radikal bebas mempunyai elektron yang tak berpasangan. Dengan demikian radikal bebas sangat reaktif terhadap senyawa lain atau terhadap jenisnya sendiri. Walaunpun demikian, ada sejumlah radikal bebas yang mempunyai "umur" yang panjang karena kestabilannya, yang dikategorikan sebagai berikut:
- Radikal Stabil

Ada juga contoh radikal tiazil, yang mana mempunyai reaktivitas yang rendah dan stabilitas termodinamika yang tinggi dengan stabilisasi resonansi π yang terbatas.
- Radikal Kokoh
- Diradikal


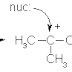
Tolong jelaskan mengapa pada molekul radikal bebas ketika kehilangan elektron menyebabkan molekul tersebut menjadi tidak stabil?
BalasHapusbaik saya akan menjawab pertanyaan dari anda, Radikal bebas adalah molekul yang kehilangan elektron, sehingga molekul tersebut menjadi tidak stabil dan selalu berusaha mengambil elektron dari molekul atau sel lain. Dengan kata lain radikal bebas merupakan atom/gugus yang memiliki satu atau lebih elektron yang tidak berpasangan. Radikal bebas ini merupakan spesies yang sangat reaktif sehingga umurnya pendek. Dalam reaksi kimia, radikal bebas sering dituliskan sebagai titik yang ditempatkan pada simbol atom atau molekul. Radikal bebas mempunyai elektron yang tak berpasangan. Dengan demikian radikal bebas sangat reaktif terhadap senyawa lain atau terhadap jenisnya sendiri. Walaunpun demikian, ada sejumlah radikal bebas yang mempunyai "umur" yang panjang karena kestabilannya, yang dikategorikan sebagai berikut: Radikal StabilContoh utama radikal stabil adalah dioksigen molekular (O2) dan nitrat oksida (NO).
HapusRadikal organik dapat berumur panjang karena terbentuk pada sebuah sistem π ter
konjugasi.
Contohnya yaitu radikal turunan α
-tokoferol (vitamin E). Contoh penulisan radikal bebas berikut sebagai hasil dari pemecahan homolitik: Cl2→C1• + Cl•
Pemutusan homolitik pada pemecahan ikatan digambarkan dengan penarikan satu elektron. Hal ini digunakan untuk membedakan dengan pemutusan heterolitik yang menggunakan anak panah bermata ganda pada umumnya
Bagaimana cara mengurangi terbentuknya radikal bebas?
BalasHapusterimakasih, saya akan menjawab pertanyaan anda, Radikal bebas adalah molekul yang tidak sempurna dan tidak stabil. Molekul merupakan blok pembangun paling dasar di alam misalnya oksigen dan asam lemak. Elekron-elektron menahan molekul agar dapat bersatu. Molekul yang normal memiliki elektron-elektron yang berpasangan, seandainya terdapat molekul yang kehilangan elektronnya maka ia akan berubah menjadi radikal bebas. Radikal bebas ini akan menjadi tidak seimbang dan memiliki sifat yang sangat reaktif terhadap molekul lainnya. Selanjutnya radikal bebas ini akan "membajak" atau mencuri elektron yang hilang dari dirinya dengan jalan mengambilnya dari molekul lainnya. Ketika hal ini terjadi maka reaksi berantaipun terjadi, molekul yang barusan dicuri elektronnya pun akan mencuri elektron dari molekul lainnya, demikian seterusnya. Kerusakan yang diakibatkan oleh radikal bebas ini disebut dengan istilah oksidasi. Radikal bebas biasanya berasal dari asap rokok, drugs (obat-obatan), alkohol, polusi udara, dll. Selain itu radikal bebas juga tercipta jika kita berolahraga terlalu berlebihan dikarenakan terdapat proses pergantian oksigen yang cepat, radikal bebas tercipta ketika mengalami trauma fisik, ketika kita mengalami luka, infeksi maupun stress emosional. Level radikal bebas ini akan meningkat setelah seseorang terkena stroke atau serangan jantung. Asap atau polusi udara biasanya merupakan sumber radikal bebas yang umumnya kita jumpai dalam kehidupan sehari-hari karena ia mengandung beberapa kombinasi aktif yang dapat memproduksi oksidan yang merusak. Untuk mencegah atau mengurangi penyakit kronis karena radikal bebas diperlukan antioksidan. Senjata yang paling ampuh untuk melawan atau memperlambat kerusakan akibat radikal bebas adalah dengan ANTIOKSIDAN. Ada dua macam antioksidan, yaitu antioksidan internal dan eksternal
Hapus1.Antioksidan internal yaitu atioksidan yang diproduksi oleh tubuh sendiri, disebut
pula sebagai “Antioksidan Primer” Secara alami tubuh mampu menghasilkan antioksidan sendiri, tetapi kemampuan ini pun ada batasnya. Sejalan bertambahnya usia, kemampuan tubuh untuk memproduksi antioksidan alami pun akan semakin berkurang. Hal ini lah yang menyebabkan stres oksidatif, yaitu suatu keadaan dimana jumlah radikal bebas melebihi kapasitas kemampuan netralisasi antioksidan. Yang termasuk Antioksidan primer ini adalah :
– Super Oxide Dismutase (SOD)
– Gluthation Peroxidase (GPx)
– Katalase (Cat)
2. Antioksidan eksternal tidak dihasilkan oleh tubuh tetapi berasal dari makanan seperti Vitamin A, beta karoten, Vitamin C, Vitamin E, Selenium, Flavonoid, dll. Antioksidan yang berasal dari makanan atau didapat dari luar tubuh disebut juga antioksidan sekunder.
Antioksidan
Antioksidan dapat didefinisikan sebagai suatu zat yang dapat menghambat / memperlambat proses oksidasi. Oksidasi adalah jenis reaksi kimia yang melibatkan pengikatan oksigen, pelepasan hydrogen, atau pelepasan elektron. Proses oksidasi adalah peristiwa alami yang terjadi di alam dan dapat terjadi dimana-mana tak terkecuali di dalam tubuh kita.
Tolong jelaskan apa yg menyebabkan keadaan non radikal dioksigen lebih stabil dari kaedaan radikalnya?
BalasHapusSelamat malam krisna, terima kasih informasinya. Saya ingin bertanya, apa saja keuntungan dan kerugian radikal bebas bagi tubuh kita?
BalasHapusKeuntunganny: sebagai dari sitem pertahanan tubuh, melindungi tubuh dari virus dan bakteri, mambantu terjadinya reaksi penting dalam tubuh dan dapat manfaatkan untuk memproduksi obat-obatan.
HapusKerugiannya: kerusankan RNA dan jaringan, gangguan hormon,kulit tampak kusam dan kendur, katarak
Dalam materi halogenasi alilik dsebutkan disitu Dalam reaksi ini diperlukan inisiator senyawa peroksida, atau cahaya ultraviolet pertanyaan saya apakah ada senyawa lain dari senyawa diatas yang bisa digunakan tolong jelaskan?
BalasHapusTerimakasih
Senyawa apa saja selain dari senyawa cl2 -> Cl. Cl yang dapat membentuk reaksi radikal bebas dan jelaskan mekanismenya
BalasHapusYou should see how my friend Wesley Virgin's biography starts in this shocking and controversial video.
BalasHapusAs a matter of fact, Wesley was in the army-and soon after leaving-he discovered hidden, "MIND CONTROL" secrets that the government and others used to get whatever they want.
As it turns out, these are the EXACT same SECRETS many celebrities (especially those who "come out of nowhere") and top business people used to become wealthy and successful.
You probably know that you use less than 10% of your brain.
Really, that's because the majority of your brainpower is UNTAPPED.
Perhaps that conversation has even taken place IN YOUR very own head... as it did in my good friend Wesley Virgin's head 7 years ago, while riding a non-registered, beat-up garbage bucket of a car without a driver's license and $3.20 on his debit card.
"I'm very fed up with going through life payroll to payroll! Why can't I become successful?"
You've taken part in those thoughts, isn't it right?
Your success story is waiting to start. All you need is to believe in YOURSELF.
CLICK HERE TO LEARN WESLEY'S SECRETS
Water Hack Burns 2lb of Fat OVERNIGHT
BalasHapusAt least 160000 women and men are utilizing a easy and secret "water hack" to drop 2 lbs every night while they sleep.
It is simple and works on everybody.
You can do it yourself by following these easy steps:
1) Get a clear glass and fill it half glass
2) And then learn this crazy HACK
you'll become 2 lbs thinner in the morning!
saya mau bertanya
BalasHapusJelaskan perbedaan mekanisme reaksi substitusi radikal bebas pada senyawa alifatik dan senyawa aromatik
Thank you sangat membantu
BalasHapus