STEREOKIMIA


Stereokimia
adalah susunan ruang dari atom dan gugus fungsi dalam molekul umumnya
molekul organik dalam obyek tiga dimensi yang merupakan hasil hibridisasi dan ikatan secara geometri dari atom dalam molekul. Artinya bagaimana atom-atom dalam sebuah molekul diatur dalam ruang satu terhadap ruang yang lainnya. Perlu diketahui bahwa stereokimia ini sangatlah penting. bahkan karena seterokimia ini, sebuah struktur yang memiliki rumus molekul sama hanya karena susunannya berbeda akan mengakibatkan fungsi yang berbeda pula, hal ini sering terjadi di dunia kesehatan. pada produk hasil sintesis. produk berupa rasemat, yaitu dua produk isomer yang berlawanan strukturnya.
molekul organik dalam obyek tiga dimensi yang merupakan hasil hibridisasi dan ikatan secara geometri dari atom dalam molekul. Artinya bagaimana atom-atom dalam sebuah molekul diatur dalam ruang satu terhadap ruang yang lainnya. Perlu diketahui bahwa stereokimia ini sangatlah penting. bahkan karena seterokimia ini, sebuah struktur yang memiliki rumus molekul sama hanya karena susunannya berbeda akan mengakibatkan fungsi yang berbeda pula, hal ini sering terjadi di dunia kesehatan. pada produk hasil sintesis. produk berupa rasemat, yaitu dua produk isomer yang berlawanan strukturnya.
Dibawah ini dapat kita lihat struktur antara kanji dan selulosa.


Jika dibandingkan maka kedua molekul tersebut sama persis formula kimianya, namun faktanya sangat berbeda antara kanji dan selulosa. baik dari segi fungsi maupun fisiknya. ya, itulah isomer.
tapi bukan isomer biasa, ini ialah stereoisomer dimana isomer tak berbeda pada susunannya, tapi yang berbeda ialah bentuk 3 dimensinya. bisa dilihat pada selulosa, ikatan pada atom O penghubung letaknya equatorial keduanya, sedangkan pada kanji ikatan pada atom O letaknya equatorial dan axial.
Axial ialah ikatan yang letaknya vertikal, atas atau bawah sedangkan equatorial yang terletak horizontal yaitu pada kanan atau kiri.

Selulosa (sumber :wikipedia)

Kanji ( sumber: wikipedia)
Jika dibandingkan maka kedua molekul tersebut sama persis formula kimianya, namun faktanya sangat berbeda antara kanji dan selulosa. baik dari segi fungsi maupun fisiknya. ya, itulah isomer.
tapi bukan isomer biasa, ini ialah stereoisomer dimana isomer tak berbeda pada susunannya, tapi yang berbeda ialah bentuk 3 dimensinya. bisa dilihat pada selulosa, ikatan pada atom O penghubung letaknya equatorial keduanya, sedangkan pada kanji ikatan pada atom O letaknya equatorial dan axial.
Axial ialah ikatan yang letaknya vertikal, atas atau bawah sedangkan equatorial yang terletak horizontal yaitu pada kanan atau kiri.
Agar dapat berinteraksi dengan reseptor dan menimbulkan
respon biologis, molekul obat harus mempunyai struktur dengan derajad
kespesifikan yang tinggi. Interaksi obat-reseptor dipengaruhi oleh distribusi
muatan elektronik dalam obat dan reseptor serta bentuk konformasi obat dan
reseptor sedangkan aktivitas obat tergantung pada stereokimia molekul obat,
jarak antar atom atau gugus dan distribusi elektronik dan konfigurasi molekul.
Perbedaan aktivitas farmakologis dari stereoisomer disebabkan oleh perbedaan
dalam distribusi isomer dalam tubuh, perbedaan dalam sifat-sifat interaksi
obat-reseptor dan perbedaan dalam adsorpsi isomer-isomer pada permukaan
reseptor.
Ada beberapa pendapat mengenai sterokimia menurut para ahli,yaitu:
Ada beberapa pendapat mengenai sterokimia menurut para ahli,yaitu:
- Jean-Baptiste Biot (1774-1862)
- Louis Pasteur (1822-1895)
Penelitian tambahan oleh Pasteur mengungkapkan bahwa salah satu komponen dari asam tartrat dapat dimanfaatkan untuk gizi oleh mikro-organisme tetapi yang lain tidak bisa. Berdasarkan percobaan ini, Pasteur menyimpulkan bahwa sifat biologis zat kimia tidak hanya tergantung pada sifat dari atom yang terdiri dari molekul tetapi juga pada cara di mana atom-atom ini tertata dalam ruang.
- Jacobus van't Hoff (1852-1911)
Untuk CH4 tetrahedral, empat hidrogen setara berada di sudut dengan sudut HCH dari 109,5 °
Karbon tetrahedral tidak hanya bekerja sama dengan tidak adanya isomer CH3Y dan CH2YZ, tetapi juga meramalkan adanya isomer bayangan cermin. Ketika karbon membuat empat ikatan tunggal dengan empat kelompok berbeda seperti CHFClBr, nonsuperimposable cermin-gambar molekul (enantiomer) ada:
Ini enantiomer menampilkan sifat fisik hampir sama kecuali untuk arah rotasi dari cahaya terpolarisasi. Sebuah campuran yang sama dari si kembar cermin gambar secara optik tidak aktif sejak rotasi membatalkan satu sama lain. Sebuah karbon dengan empat kelompok yang berbeda dikatakan memiliki "pusat kiral." Contoh molekul yang mengandung satu atau lebih pusat kiral ditunjukkan dengan tanda bintang merah. Meskipun atom hidrogen tidak ditampilkan, menganggap mereka hadir untuk memberikan karbon empat obligasi.
Sebagai jumlah pusat kiral (C *) meningkat, begitu juga jumlah stereoisomer (struktur yang sama tetapi berbeda dalam orientasi ruang). Jumlah maksimum stereoisomer yang mungkin adalah 2x di mana x adalah jumlah pusat kiral per molekul.
- Emil Fisher (1852-1919)
Fisher menggunakan representasi silang (sekarang disebut Fisher proyeksi) untuk membedakan bentuk tiga dimensi. Proyeksi Fisher ditampilkan untuk D dan Lglucose (D / L inovasi lain Fisher).
- Vladmir Prelog (1906-1998)
Pada stereokimia terdapat tiga aspek
penting , diantaranya sebagai berikut :
1.Konformasi
molekul: Berkaitan dengan bentuk molekul dan bagaimana bentuk molekul itu diubah
akibat adanya putaran bebas disepanjang ikatan C-C tunggal.
2.Konfigurasi
berkaitan dengan Kiralitas molekul: Bagaimana penataan atom-atom disekitar atom
karbon yang mengakibatkan terjadinya
isomer.
3.Isomer
Geometrik : Terjadi karena ketegaran (rigit) dalam molekul yang
mengakibatkan adanya isomer .
A. Isomer Geometri dalam Alkena dan Senyawa Siklik
Isomer adalah senyawa-senyawa karbon
yang memiliki rumus molekul sama tetapi rumus strukturnya berbeda. Pada
senyawa hidrokarbon, rumus kimia menunjukkan jumlah atom karbon dan setiap
unsur yang terdapat dalam satu molekul senyawa. Rumus kimia senyawa propana
adalah C3H6, rumus kimia ini menunjukkan bahwa setiap
molekul propana terdiri atas tiga atom karbon dan enam atom hidrogen. Rumus
struktur molekul adalah rumus kimia yang menunjukkan cara atom-atom diikatkan
antara satu sama lain dengan ikatan kovalen dalam struktur molekul senyawa
tersebut.
Keisomeran
senyawa hidrokarbon adalah suatu fenomena, karena dua atau lebih senyawa
hidrokarbon memiliki rumus kimia yang sama, tetapi memiliki struktur molekul
yang berbeda. Struktur-struktur molekul yang berbeda tetapi rumus kimianya sama
ini disebut isomer. Terdapat 4 jenis isomer, yaitu isomer rangka, isomer
posisi, isomer fungsi, dan isomer geometri. Isomer rangka dan isomer posisi
sering disebut isomer struktur.
Isomer memiliki dua Kelas Utama
yaitu Konstitusional isomer dan stereoisomer.
·
Konstitusional
isomer
konstitusional isomer merupakan berbeda pada cara atom tersebut terhubung satu
sama lain. Sifatnya yaitu:
a) Nama IUPAC yang berbeda
b) Gugus fungsi bisa sama tau beda
c) Sifat fisik yang berbeda, sehingga
bisa dipisahkan dengan pemisahan yang didasarkan perbedaan sifat fisik seperti
distilasi
d) Sifat kimia yang berbeda. sehingga
direaksikan akan menghasilkan produk yang berbeda pula
·
Stereoisomer
hanya berbeda pada cara atom berorientasi pada ruang. Stereoisomer memiliki
nama IUPAC yang identik(kecuali kata depan seperti trans atau cis). Memiliki
gugus fungsi yang sama. Susunan dari tiga dimensi disebut konfigurasi.
Stereoisomer hanya berbeda dalam konfigurasinya.
Isomer geometri adalah
isomer yang terjadi pada dua molekul yang mempunyai rumus molekul sama, tetapi
berbeda dalam penataan atom atom dalam ruang. Selalu ingat bahwa sebenarnya
molekul molekul itu ada pada ruang tiga dimensi yang atom atomnya berikatan
dengan penataan sedemikian rupa. Isomer geometri terjadi karena ketegaran
(rigidity) dalam molekul dan hanya dijumpai dalam dua kelompok senyawa yaitu
alkena dan senyawa siklik.
Isomeri
geometrik terjadi karena rotasi ntidak
bebas mengelilingi suatu ikatan rangkap . Isomer geometri dalam Alkena (Cis dan
Trans). Di akibatkan oleh ketegaran dalam molekul. Dijumpai dalam dua kelas
senyawa: alkena dan senyawa siklik. Senyawa yang mempunyai ikatan rangkap tak
dapat berputar dengan ikatan rangkap sebagai sumbunya, tanpa mematahkan ikatan
pi nya. Karena kekakuan ikatan pi, gugus-gugus yang terikat pada ikatan pi
terletak tetap dalam ruang relatif satu sama lain. Syarat isomer geometri dalam
alkena, yaitu tiap atom karbon yang terlibat dalam ikatan pi mengikat dua gugus
yang berlainan, misalnya H dan Cl. Jika salah satu atom karbon berikatan
rangkap itu mempunyai dua gugus identik, misalnya dua atom H atau dua gugus CH3,maka
tak mungkin terjadi isomrotaeri geometri. Rotasi tidak bebas dalam senyawa bebas atom atom yang tergabung dalam suatu cincin tidak bebas berotasi mengelilingi ikatan ikatan sigma (dari) cincin itu. Rotasi mengelilingi ikatan-ikatan sigma cincin akan memutus agar atom-atom atau gugus gugus yang terikat, melewati pusat cincin itu. Tetapi gaya tolak Van der Walls menghalangi terjadinya gerakan ini, terkecuali jika cincin berdiri dari sepuluh atom karbon atau lebih. Dalam senyawa organik cincin yang lebih lazim ialah cincin lima atau enam anggota. Oleh karena itu pembahasan dipusatkan pada cincin dengan nam atom karbon atau kurang. Berbeda halnya dengan gugus atau atom yang terikat oleh ikatan rangkap dimana ada ikatan sigma dan pi dalam molekul (sp2). Gugus atau atom ini tidak dapat berotasi tanpa mematahkan ikatan pi –nya terlebih dahulu. Sehingga ada sifat ketegaran adalam molekul yang menyebabkan jika letak atom atau gugusnya berbeda, maka sifat senyawa tersebut berbeda pula. Artinya lagi kedua senyawa tersebut adalah berbeda.
Jika suatu gugus atau
atom terikat oleh ikatan sigma saja (sp3, umumnya pada senyawa yang berikatan
tunggal), maka gugus atau atom yang terikat tersebut dapat berputar sedemikian
rupa sehingga bentuk molekulnya akan selalu sama.
Contoh :
Berbeda halnya dengan
gugus atau atom yang terikat oleh ikatan rangkap dimana ada ikatan sigma dan pi
dalam molekul (sp2). Gugus atau atom ini tidak dapat berotasi tanpa mematahkan
ikatan pi –nya terlebih dahulu. Sehingga ada sifat ketegaran adalam molekul
yang menyebabkan jika letak atom atau gugusnya berbeda, maka sifat senyawa
tersebut berbeda pula. Artinya lagi kedua senyawa tersebut adalah berbeda.
Contoh :
Kedua senyawa disamping adalah berbeda dimana pada senyawa pertama letak atom Cl-nya sesisi sedangkan
pada senyawa kedua letak atom Cl-nya berbeda sisi. Senyawa pertama tidak mudah
diubah menjadi senyawa kedua, begitu juga sebaliknya karena ikatan rangkap
antara atom karbonnya berisifat tegar.
Jika dalam senyawa, dua
gugus atau atom yang sama terletak pada satu sisi ikatan pi, maka disebut
dengan cis, dan jika letaknya berlwanan disebut dengan trans.
 Perbedaan kedua senyawa
dapat dibuktikan dari perbedaan sifat fisikanya seperti titik didih kedua
senyawa yang berbeda. Senyawa cis-1,2-dikloroetena memiliki titik didh 60
derajat celsius sedangkan senyawa trans-1,2-dikloroetena memiliki titik didih
48 derajat celsius. kedua senyawa tersebut tidak bisa dikatakan sebagai isomer structural karena ikatan atom atom
dan lokasi ikatan rangkap pada kedua senyawa tersebut adalah sama sehingga
bukan merupakan isomer struktural. Pasangan senyawa diatas secara umum termasuk
ke dalam kelompok stereoisomer, yaitu senyawa yang rumus strukturnya sama
tetapi yang berbeda hanyalah penataan atom atom adalam ruang. Secara lebih
spesisfik, kedua pasangan senyawa diatas disebut berisomer geometri (cis –
trans). Hal yang perlu diingat bahwa “Senyawa
alkena yang berisomer geometri bukanlah termasuk berisomer struktural, karena
secara struktural ( letak atom atom dan posisi ikatan rangakap) adalah sama”.
Perbedaan kedua senyawa
dapat dibuktikan dari perbedaan sifat fisikanya seperti titik didih kedua
senyawa yang berbeda. Senyawa cis-1,2-dikloroetena memiliki titik didh 60
derajat celsius sedangkan senyawa trans-1,2-dikloroetena memiliki titik didih
48 derajat celsius. kedua senyawa tersebut tidak bisa dikatakan sebagai isomer structural karena ikatan atom atom
dan lokasi ikatan rangkap pada kedua senyawa tersebut adalah sama sehingga
bukan merupakan isomer struktural. Pasangan senyawa diatas secara umum termasuk
ke dalam kelompok stereoisomer, yaitu senyawa yang rumus strukturnya sama
tetapi yang berbeda hanyalah penataan atom atom adalam ruang. Secara lebih
spesisfik, kedua pasangan senyawa diatas disebut berisomer geometri (cis –
trans). Hal yang perlu diingat bahwa “Senyawa
alkena yang berisomer geometri bukanlah termasuk berisomer struktural, karena
secara struktural ( letak atom atom dan posisi ikatan rangakap) adalah sama”.
Syarat suatu senyawa yang
memiliki isomer geometri adalah tiap atom akrbon yang berikatan pi (rangkap)
harus mengikat gugus – gugus yang berlainan.
Contoh : 2 – pentena
Pada senyawa pentena
diatas, kedua atom karbon yang berikatan rangkap mengikat gugus gugus yang
berlainan. Atom karbon pertama mengikat atom H dan gugus CH3, sedangkan atom
kedua mengikat H dan gugus – CH2CH3. Senyawa pentena diatas disebut memiliki
isomer geometri.
Jika gugus atau atom yang
diikat oleh karbon yang berikatan rangkap ada yang sama, walaupun mempunyai
ikatan rangkap yang tegar dan tidak dapat berotasi, tetapi senyawa tersebut
tidak berisomer geometri.
Perhatikan senyawa
dibawah
Karbon pertama yang
berikatan rangkap sama sama mengikat atom H, sehingga bentuk pertama dan kedua
senyawa diatas adalah sama walaupun penggambaran strukturnya pada bidang datar
terlihat berbeda. Ingatlah bahwa molekul sebenarnya ada pada ruang tiga
dimensi.
Isomer geometri pada
hidrokarbon siklik
- Keterbatasan perputaran atom – atom yang terikat pada masing – masing atom C.
- Rintangan perputaran atom – atom tidak sebesar rintangan atom – atom yang terikat pada atom C ikatan rangkap, tetapi lebih besar dari pada rintangan pada hidrokarbon rantai terbuka karena pengaruh regangan sudut.
- Ikatan s pada hibridisasi sp3 mempunyai sudut 109,5o, beberapa ikatan siklik mempunyai sudut ikatan tidak demikian.
- Besarnya rintangan akibat regangan sebanding selisih sudut ikatan dengan 109, 5o.
- Siklopropana mempunyai sudut ikatan 60, siklopentana 108.
- Molekul siklik besar hampir tidak ada rintangan karena regangan
- Sikloheksana membentuk konformasi kursi supaya sudut ikatan mendekati 109,5o.
- Dalam sikloheksana dikenal subtituen:
Aksial
à ikatan pada salah satu hidrogen terletak
dalam bidang cincin
Ekuatorial
à ikatan ke hidrogen lain yang tegak lurus
sumbu
B. Konformasi dan Kiralitas Senyawa Rantai Terbuka
- Konformasi senyawa rantai terbuka
Konformasi Molekul
: bentuk molekul dan bagaimana bentuk ini dapat berubah. Dalam senyawa
rantai terbuka, gugus-gugus yang terikat oleh ikatan sigma dapat berotasi
mengelilingi ikatan itu. Oleh karena itu atom-atom dalam suatu molekul rantai
terbuka dapat memiliki tak terhingga banyak posisi di dalam ruang relatif satu
terhadap yang lain. Memang etana merupakan sebuah molekul kecil, tetapi etana
dapat memiliki penataan dalam ruang secara berlain-lainan, inilah yang disebut
konformasi.
Dalam senyawa rantai terbuka gugus gugus yang terikat oleh ikatan sigma dapat berotasi mengelilingi ikatan tersebut. Oleh karena itu atom – atom dalam suatu molekul – molekul terbuka dapat memiliki tak terhingga banyak posisi di dalam ruang relatif satu terhadap yang lain. Memang etana sebuah molekul kecil, tetapi etana dapat memiliki penataan dalam ruang secara berlain – lainan, penataan tersebut disebut konformasi. Untuk mengemukakan konformasi digunakan
tiga jenis rumus : rumus dimensional, rumus bola dan pasak dan proyeksi Newman.
Suatu rumus
bola dan pasak dan rumus dimensional adalah representasi 3dimensi dari model molekul suatu senyawa. Suatu proyeksi Newman adalah pandangan ujung ke ujung dari dua atom karbon saja dalam molekul itu.
Ikatan yang menghubungkan kedua atom karbon ini tersembunyi.
Ketiga ikatan dari karbon depan tampak menuju ke pusat proyeksi, dan ketiga ikatan dari karbon
belakang hanya tampak sebagian.
Proyeksi Newman dapat digambar untuk molekul dengan dua atom karbon atau lebih. Karena pada tiap kali hanya dua atom karbon dapat ditunjukan dalam proyeksi itu, maka lebih dari satu
proyeksi newman dapat digambar untuk sebuah molekul. Suatu molekul dapat memiliki beberakonformasi
atau konformasi yang berbedabeda karena disebabkan adanya rotasi mengelilingi ikatan sigma. Konformasi yang berbeda
beda itu disebut konformer (dari kata “conformational isomers”)
Memang etana
merupakan sebuah molekul kecil, tetapi etana dapat memiliki penataan dalam
ruang secara berlain-lainan.
Untuk
menggambarkan konformasi, digunakan tiga jenis rumus yaitu :
·
Rumus
dimensional
·
Rumus
bola-dan-pasak
·
Proyeksi
Newman
- Kiralitas senyawa rantai terbuka
Molekul kiral adalah molekul yang
mempunyai bayangan cermin tidak superimposabel (tidak dapat bertumpukan). Yang
menyebabkan adanya kiralitas adalah adanya senyawa karbon yang tidak simetris.
Atom C kiral adalah atom karbon yang mempunyai empat substituen yang
berbeda.
Istilah kiral berasal dari kata
Yunani χειρ (kheir) yang berarti tangan. Istilah kiral secara umum digunakan
untuk menggambarkan suatu objek yang tidak dapat bertumpukan secara pas pada
bayangannya. Akiral (tidak kiral) adalah benda yang identik dengan bayangan
cermin. Untuk mempelajari kiralitas, dapat menggunakan tangan manusia sebagai
perumpaaan. Perhatikan contoh kiralitas asam amino berikut ini.
Molekul
kiral yang saling mempunyai bayangan cermin satu sama lain disebut dengan
enantiomer atau isomer optik.
Kiralitas adalah suatu keadaan yang menyebabkan dua molekul dengan struktur
yang sama tetapi berbeda susunan ruang dan konfigurasinya. Atom
yang menjadi pusat kiralitas dikenal dengan istilah atom kiral. Atom
kiral adalah atom yang mengikat gugus yang semuanya berbeda. Bila dalam suatu molekul terdapat satu pusat kiral maka akan terdapat dua
stereoisomer dari senyawa tersebut yang dikenal dengan istilah enantiomer.
a. Sepasang enantiomer merupakan bayangan cermin satu terhadap yang lainnya.
b. Kedua enantiomer tidak bisa ditumpangtindihkan setelah dilakukan operasi
simetri apapun.
Bila dalam satu molekul
terdapat lebih dari satu pusat kiral maka akan terdapat lebih dari satu pasang
enantiomer à
diastereoisomer/diastereomer











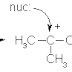
Apakah rantai terbuka akan memiliki titik didih yang lebih tinggi jika dibandingkan dengan rantai tertutup?
BalasHapusTitik Didih suatu zat cair dipengaruhi oleh tekanan udara, artinya makin besar tekanan udara makin besar pula titik didih zat cair tersebut. Pada tekanan dan temperatur udara standar (76 cmHg, 25ºC) titik didih air sebesar 100ºC. Artinya pelarut murni akan mendidih bila tekanan uap jenuh pada permukaan cairan sama dengan tekanan udara luar. Pada sistem terbuka, tekanan udara luar adalah 760 mmHg (tekanan udara pada permukaan larutan) dan suhu pada tekanan udara luar 760 mmHg disebut titik didih normal. Titik didih suatu cairan adalah suhu pada saat tekanan uap jenuh cairan itu sama dengan tekanan luar (tekanan yang diberikan pada permukaan cairan). Dari definisi ini kita ketahui bahwa titik didih cairan bergantung pada tekanan udara pada permukaan cairan. Itulah sebabnya, titik didih air di gunung berbeda dengan di pantai. Pada saat tekanan uap sama dengan tekanan udara luar maka gelembung-gelembung uap dalam cairan bergerak ke permukaan dan masuk fase gas. Titik didih dapat digunakan untuk memperkirakan secara tak langsung berapa kuatnya daya tarik antar molekul cairan. Cairan yang memiliki gaya tarik antar molekul kuat, akan memiliki titik didih yang tingi, begitu juga sebaliknya. Cairan yang gaya tarik antar molekulnya kuat, titik didihnya tinggi dan sebaliknya bila gaya tariknya lemah maka titik didihnya rendah. Ketergantungan titik didih pada gaya tarik antar molekul terlihat dimana titik didih beberapa senyawa halogen dari unsur – unsur golongan IVA, VA , VIA , dan VII A, dibandingkan. Kita lihat senyawa pada golongan IV A terlebih dahulu karena bentuknya yang ideal , yaitu ukuran atom yang naik dari atas ke bawah.
HapusSifat periodik unsur titik didih dan kelogaman :
· Satu periode : Dari kiri ke kanan makin bertambah puncaknya pada golongan IV A kemudian menurun drastis sampai golongan VIII A
· Satu golongan : Golongan I A sampai IV A dari atas ke bawah makin rendah titik didih dan tititk lelehnya Golongan V A sampai VIII A dari atas ke bawah titik didih dan titik leleh makin tinggi.
Tolong jelaskan sedikit tentang isomer struktural
BalasHapusIsomer struktural (structural isomers) atau dikenal sebagai isomer konstitusional, adalah sebutan untuk jenis isomer yang berbeda dalam struktur dasar atau jenis ikatan-ligan yang tekait pada logam pusat dan melalui atom. Beberapa jenis isomerisme struktural (isomerisme ionisasi, isomerisme koordinasi, dan isomerisme tautan). Isomer Struktural Kata Kunci: isomer struktural Ditulis oleh Jim Clark pada 23-09-2004 Halaman ini menjelaskan tentang isomer struktur, dan berbagai contoh yang dapat mengakibatkan terjadinya isomer struktur. Apa yang dimaksud dengan struktur isomer? Arti isomer Isomer adalah molekul yang memiliki formula molekul yang sama tetapi memiliki pengaturan yang berbeda pada bentuk 3D. Tidak termasuk pengaturan berbeda yang diakibatkan rotasi molekul secara keseluruhan ataupun rotasi pada ikatan tertentu (ikatan tunggal). Sebagai contoh, keduanya adalah molekul yang sama. Dan keduanya bukan isomer. Keduanya merupakan butan. Isomer juga tidak terjadi pada rotasi di ikatan ikatan tunggal. Jika anda memiliki sebuah model molekul didepan mata anda, anda harus mempretelinya dan menyusung ulang kembali untuk menghasilkan isomer dari molekul tersebut. Pada salah satunya rantai karbon berada dalam dalam bentuk rantai panjang, dimana yang satunya berbentuk rantai karbon bercabang. Hati-hati untuk tidak menggambar isomer yang salah yang hanya merupakan rotasi sederhana dari molekul awal. Sebagai contoh, struktur dibawah ini merupakan versi lain dari rantai panjang butan yang diputar apa daerah tengah dari rantai karbon. Anda dapat melihatnya dengan jelas pada Pada saat yang sama anda harus memindahkan hidrogen dari tengah ke ujung. Contoh lain terjadi pada alkohol, seperti pada C4H9OH Hanya kedua isomer ini yang bisa anda dapatkan dari rantai dengan empat buah karbon bilamana anda tidak mengubah rantai karbon itu sendiri. Anda boleh, mengubahnya dan menghasilkan 2 buah isomer lagi. Anda juga bisa mendapatkan isomer posisi dari rantai benzen. Contoh padamodel dibawah ini. Ini merupakan contoh yang sebelumnya telah kita gunakan diatas. Pentane, C5H12, mempunyai tiga rantai isomer. Jika anda berpikir anda bisa menemukan yang lain, maka yang anda temukan hanyalah molekul yang sama yang diputar. Jika anda masih meragukannya gunakanlah sebuah model. Isomer posisi formula molekul C7H8Cl. Ada empat isomer berbeda yang bisa anda buat tergantung pada posisi dari atom klorin. Pada sebuah kasus terikat pada atom dari karbon yang berikatan dengan cincin, dan ada tiga buah lagi kemungkinan saat berikatan dengan cincin karbon. Isomer Dari Wikipedia, ensiklopedia bebas Artikel ini adalah tentang konsep kimia. Untuk "Isomer" dari inti atom, lihat isomer nuklir . Dalam kimia , isomer (dari ἰσομερής Yunani, isomerès; ISO = "sama", méros = "bagian") adalah senyawa yang sama dengan rumus struktural . [1] molekul tetapi berbeda rumus Isomer tidak perlu berbagi sifat yang mirip, kecuali mereka juga memiliki sama kelompok fungsional . Ada kelas yang berbeda dari isomer, seperti stereoisomer, enantiomer, isomer geometri, dll (lihat grafik di bawah). Ada dua bentuk utama dari isomer:isomer struktural dan stereoisomerism (isomer spasial).
HapusSaya kurang mengerti tentang postingan anda yaitu enantiomer tidak bisa ditumpangtindihkan setelah dilakukan operasi simetri apapun tolong dijelaskan?
BalasHapusApa yang dimaksud konformasi molekul ?
BalasHapusDid you realize there is a 12 word phrase you can say to your crush... that will induce deep feelings of love and instinctual attractiveness for you deep inside his chest?
BalasHapusBecause deep inside these 12 words is a "secret signal" that fuels a man's instinct to love, please and protect you with all his heart...
12 Words Will Trigger A Man's Love Response
This instinct is so built-in to a man's mind that it will drive him to try harder than ever before to make your relationship the best part of both of your lives.
In fact, fueling this powerful instinct is so important to having the best ever relationship with your man that once you send your man a "Secret Signal"...
...You will soon notice him open his soul and mind for you in such a way he haven't experienced before and he'll see you as the one and only woman in the galaxy who has ever truly tempted him.
Boleh tau daftar pustakanya?
BalasHapusada daftar pustakanya kak?
BalasHapus