ORBITAL DAN PERANANNYA DALAM IKATAN KOVALEN
A. Orbital Hibrida dari Nitrogen ke Oksigen
Hibridisasi adalah sebuah konsep bersatunya orbital-orbital atom atau penyusunan kembali orbital untuk membentuk
orbital hibrid yang baru yang
sesuai dengan penjelasan kualitatif sifat ikatan atom. Konsep orbital-orbital
yang terhibridisasi sangatlah berguna dalam menjelaskan bentuk orbital molekul dari sebuah molekul.
Terdapat 3 jenis hibridisasi yaitu
11. Hibridisasi sp3
HIbridisasi sp3 menjelaskan
struktur molekul tetrahendral. Hibridisasi satu orbital s dan tiga orbital
p(px,py,pz) yang menghasilkan empat orbital sp3.
22. Hibridisasi sp2
Hibridisasi sp2 menjelaskan struktur molekul
trigonal planar. Hibridisasi satu orbital s dan 2 orbital p yang menghasilkan
tiga orbital sp2
33. Hibridisasi sp
HIbridisasi sp menjelaskan struktur molekul linier.
Hibridisasi satu orbital s dan satu orbital p yang menghasilkan 2 orbital sp.
Sebagai contoh orbital hibridisasi sp3 oleh atom C (karbon) :
Atom C yang dengan nomor atom 6 memiliki konfigurasi sebagai berikut :

Pada awalnya atom C hanya memiliki 2 elektron tidak berpasangan, tapi
seperti diketahui untuk berikatan dan menjadi stabil C haruslah memiliki 4
elektron tidak berpasangan. Untuk itu 1 electron pada orbital 2s akan dieksitasi
ke orbital 2p menjadi :

Dengan demikian atom C telah memiliki 4 elektron tidak berpasangan,
sehingga mempunyai empat energy ikatan yang sama. Atom C telah membentuk 4 x sp3
.
Pada hibridisasi sp3, satu
orbital sp3 diisi oleh dua elektron dan tiga orbital sp3 diisi masing- masing
satu elektron.

3.orbital oksigen
Konsep hibridisasi berhasil meramal
struktur molekul senyawa kovalen bila atom pusat berikatan tunggal dengan
substituent (atom) yang sama. Jika tidak demikian, akan terjadi penyimpangan yaitu bila:
a. Atom pusat mempunyai pasangan electron bebas seperti NH3
b. Terdapat ikatan rangkap antara ion pusat dengan atom lain seperti HCN
c. Atom-atom yang terikat pada atom pusat berbeda keelektronegatifannya seperti H2CClF
d. Atom-atom yang terikat pada atom pusat berbeda ukurannya seperti H3CCl dan H2CClF
a. Atom pusat mempunyai pasangan electron bebas seperti NH3
b. Terdapat ikatan rangkap antara ion pusat dengan atom lain seperti HCN
c. Atom-atom yang terikat pada atom pusat berbeda keelektronegatifannya seperti H2CClF
d. Atom-atom yang terikat pada atom pusat berbeda ukurannya seperti H3CCl dan H2CClF
Ikatan rangkap konjugasi adalah ikatan rangkap selang-seling dengan ikatan
tunggal atau disebut juga elektronnya dapat berpindah-pindah (terdelokalisasi).
Ikatan rangkap terkonjugasi ialah ikatan
yang kedudukan nya di selang oleh satu ikatan tunggal seperti -CH=CH-CH=-CH.
Pengaturan kembali electron melalui orbital π, terutama dalam system konjugasi
atau senyawa organic yang atom-atomnya secara kovalen berikatan tunggal dan
ganda.
Konjugasi pada ikatan rangkap berbicara mengenai kestabilan unsur yang
bertujuan untuk bangun molekul yang lebih stabil. Konjugasi terjadi dalam senyawa organik yang atom-atomnya
secara kovalen berikatan tunggal dan ganda secara bergantian (C=C-C=C-C) dan
memengaruhi satu sama lainnya membentuk daerah delokalisasi
elektron. Delokalisasi yaitu suatu keadaan dimana
elektron valensi tersebut tidak tetap posisinya pada 1 atom, tetapi senantiasa
berpindah-pindah dari 1 atom ke atom lain atau delokalisasi yaitu berpindah.
Pada isomerisme cis dan trans.
Cis : Gugus subtituen yang
berikatan dengan ikatan rangkap berorientasi sama atau tidak berlawanan
Trans : Gugus subtituien yang
berikatan dengan ikatan rangkap saling berlawanan
Energi ikatsn sebelum ikatan π terdelokalisasi/berpindah lebih tinggi karena sebelum ikatan π berpindah mengakibatkan ikatan yang tidak stabil.

Energi ikatan sesudah ikatan π berpindah pada tempat sebelumnya akan rendah karena ketika ikatan π berpindah ikatan sebelumnya akan stabil.

Energi ikatsn sebelum ikatan π terdelokalisasi/berpindah lebih tinggi karena sebelum ikatan π berpindah mengakibatkan ikatan yang tidak stabil.
Energi ikatan sesudah ikatan π berpindah pada tempat sebelumnya akan rendah karena ketika ikatan π berpindah ikatan sebelumnya akan stabil.
Ikatan antara C-O akan lebih stabil karena kelektronegatifan O lebih tinggi sehingga afinitasnya (kemampuan berikatan) akan tinggi. Sedangkan ikatan antara C-C kurang stabil karena kelektronegatifan C lebih rendah dari atom O sehingga afinitas atom C juga akan lebih rendah dari afinitas atom O.
Antara cis dan trans yang
lebih stabil adalah trans karena cis lebih banyak halangan sterit yang
menyebabkannya tidak stabil.
Tetapi pada cis-2 butena :
- Memiliki titik lebur kecil yang berarti akan lebih cepat mencair karena jika halangan steritnya besar maka mempunyai energi kinetik besar dan molekul akan cepat merenggang sehingga akan cepat mencair.
- Memiliki titik didih yang lebih besar. Walaupun sebenarnya cis kurang stabil, tapi memiliki kerapatan (kebolehjadian menemukan elektron ) yang lebih besar , maka intensitas berikatan lebih besar jadi sulit untuk diputus sehingga membutuhkan titik didih yang lebih besar untuk memutuskan ikatan tersebut.
- Memiliki titik lebur kecil yang berarti akan lebih cepat mencair karena jika halangan steritnya besar maka mempunyai energi kinetik besar dan molekul akan cepat merenggang sehingga akan cepat mencair.
- Memiliki titik didih yang lebih besar. Walaupun sebenarnya cis kurang stabil, tapi memiliki kerapatan (kebolehjadian menemukan elektron ) yang lebih besar , maka intensitas berikatan lebih besar jadi sulit untuk diputus sehingga membutuhkan titik didih yang lebih besar untuk memutuskan ikatan tersebut.
Dan
pada trans-2 butena :
- Memiliki titik leleh yang lebih besar yang berarti akan lama mencair karena jika halangan steritnya kecil maka mempunyai energy kinetic yang lebih kecil dan molekul akan lambat merenggang sehingga akan lama mencair.
- Memiliki titik didih yang lebih kecil . walaupun trans sebenarnya stabil tapi memiliki kerapatan yang lebih kecil, maka intensitas berikatan akan lebih kecil jadi mudah untuk diputus sehingga membutuhkan titik didih yang kecil untuk memutuskan ikatan tersebut.
- Memiliki titik leleh yang lebih besar yang berarti akan lama mencair karena jika halangan steritnya kecil maka mempunyai energy kinetic yang lebih kecil dan molekul akan lambat merenggang sehingga akan lama mencair.
- Memiliki titik didih yang lebih kecil . walaupun trans sebenarnya stabil tapi memiliki kerapatan yang lebih kecil, maka intensitas berikatan akan lebih kecil jadi mudah untuk diputus sehingga membutuhkan titik didih yang kecil untuk memutuskan ikatan tersebut.
Perbedaan ikatan
sigma dan ikatan pi adalah:
-
-Ikatan sigma
(ikatan σ)
·
Ikatan kovalen
yang dibentuk oleh tumpang tindih orbital atom sepanjang sumbu antar inti.
·
Orbital tumpang
tindih berorientasi sepanjang sumbu antar inti.
·
ikatan adalah berotasi
simetris sekitar sumbu antar inti
-
-Ikatan pi
(Ikatan π)
·
Ikatan kovalen
yang dibentuk oleh tumpang tindih lateral dua orbital p yang saling paralel
tetapi berorientasi tegak lurus terhadap sumbu antar inti.
·
Orbital tumpang
tindih berorientasi tegak lurus terhadap sumbu antar inti.
·
Ikatan ini
tidak berotasi simetris sekitar sumbu antar inti.
· Ikatan pi
menyebabkan ikatan sigma tidak stabil.
·
Ikatan pi
menyebabkan pergeseran tempat sehingga yang tidak berpasangan akan mempunyai energy yang lebih tinggi di
bandingkan yang tidak berpasangan
C. Benzena
Dan Resonansi
Senyawa
benzena mempunyai rumus molekul C6H6, dan termasuk dalam
golongan senyawa hidrokarbon aromatik. Nama aromatik digunakan karena senyawa
tersebut berbau harum.dari rumus molekulnya dapat diketahui bahwa benzena
merupakan senyawa tidak jenuh karena tidak memenuhi rumus CnH2n+2. Benzena
dengan rumus C6H6 mempunyai bentuk molekul planar. Benzene tidak dapat diadisi
langsung oleh Br karena electron pada
ikatan rangkap akan menolak untuk berikatan dengan BR dan akan beresonansi
(adanya delokalisasi electron dari ikatan rangkap ke ikatan tunggal).
Tapi
benzena bisa diadisi oleh Br jika telah
direaksikan dengan FeBr3 sesuai dengan teori asam lewis. Fe disini berperan
sebagai katalis yang dapat menyedot electron untuk memutus ikatan yang
selanjutnya Br bisa masuk. Bila
dibandingkan dengan senyawa hidrokarbon lain yang mengandung 6 buah atom
karbon, misalnya heksana (C6H14) dan sikloheksana (C6H12),
maka dapat diduga bahwa benzena mempunyai derajat ketidakjenuhan yang tinggi.
Dengan dasar dugaan tersebut maka dapat diperkirakan bahwa benzena memiliki
ciri-ciri khas seperti yang dimiliki oleh alkena. Perkiraan tersebut ternyata
jauh berbeda dengan kenyataannya, karena benzena tidak dapat bereaksi seperti
alkena (adisi, oksidasi, dan reduksi).Lebih khusus lagi benzena tidak dapat
bereaksi dengan HBr, dan pereaksi-pereaksi lain yang lazimnya dapat bereaksi dengan
alkena. Sifat-sifat kimia yang diperlihatkan oleh benzena memberi petunjuk
bahwa senyawa tersebut memang tidak segolongan dengan alkena ataupun
sikloalkena.Benzena dengan gugus alkil sebagai substituen, diklasifikasikan
sebagai golongan arena. Penataan nama arena dibagi ke dalam dua golongan
berdasarkan panjang rantai alkil. Jika gugus alkil berukuran kecil (atom C6)
maka gugus alkil diambil sebagai substituen danbenzenasebagai =induknya.

Resonansi ,Metana (CH4) dan etilena (CH2=CH2) adalah contoh dari senyawa organic dengan struktur yang menggunakan garis untuk ikatan pasangan electron). Suatu garis yang menghubungkan dua lambang atom menyatakan ikatan kovalen antara dua atom.

Resonansi ,Metana (CH4) dan etilena (CH2=CH2) adalah contoh dari senyawa organic dengan struktur yang menggunakan garis untuk ikatan pasangan electron). Suatu garis yang menghubungkan dua lambang atom menyatakan ikatan kovalen antara dua atom.
Benzene
adalah contoh suatu senyawa organic yang tidak dapat digambarkan secara pasti oleh
rumus ikatan valensi tunggal.


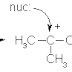
jelaskan perbedaan hibridisasi sp3, sp2, dan sp dan beri contoh?
BalasHapus1. Hibrid sp
HapusSalah satu contoh orbital sp terjadi pada Berilium diklorida. Berilium mempunyai 4 orbital dan 2 elektron pada kulit terluar. Pada hibridisasi Berilium dijelaskan bahwa orbital 2s dan satu orbital 2p pada Be terhibridisasi menjadi 2 orbital hibrida sp dan orbital 2p yang tidak tribridisasi. Diagram hibridisasinya sebagai berikut :
Hibridisasi sp membentuk geometri linear dengan sudut 180. Terjadi pada BeH2 dan BeCl2
2. Hibrid sp2
Salah satu contoh orbital hirbid sp2 diasumsikan terjadi pada Boron trifluorida. Boron mempunyai 4 orbital tapi hanya 3 eletron pada kulit terluar. Hibridisasi boron mengkombinasikan 2s dan 2 orbital 2p menjadi 3 orbital hybrid sp2 dan 1 orbital yang tidak mengalami hibridisasi. Skema hibridisasi Boron adalah sebagai berikut :
Orbital hybrid sp2 menjadi bentuk trigonal planar dengan sudut ikatan120.
3. Hibrid sp3
Hibridisasi menjelaskan atom-atom yang berikatan dari sudut pandang sebuah atom. Untuk sebuah karbon yang berkoordinasi secara tetrahedal (seperti metana, CH4), maka karbon haruslah memiliki orbital-orbital yang memiliki simetri yang tepat dengan 4 atom hidrogen. Konfigurasi keadaan dasar karbon adalah 1s2 2s2 2px1 2py1 atau lebih mudah dilihat:
(Perhatikan bahwa orbital 1s memiliki energi lebih rendah dari orbital 2s, dan orbital 2s berenergi sedikit lebih rendah dari orbital-orbital 2p)
Teori ikatan valensi memprediksikan, berdasarkan pada keberadaan dua orbital p yang terisi setengah, bahwa C akan membentuk dua ikatan kovalen, yaitu CH2. Namun, metilena adalah molekul yang sangat reaktif, sehingga teori ikatan valensi saja tidak cukup untuk menjelaskan keberadaan CH4.
Lebih lanjut lagi, orbital-orbital keadaan dasar tidak bisa digunakan untuk berikatan dalam CH4. Walaupun eksitasi elektron 2s ke orbital 2p secara teori mengijinkan empat ikatan dan sesuai dengan teori ikatan valensi, hal ini berarti akan ada beberapa ikatan CH4 yang memiliki energi ikat yang berbeda oleh karena perbedaan arah tumpang tindih orbital. Gagasan ini telah dibuktikan salah secara eksperimen, setiap hidrogen pada CH4 dapat dilepaskan dari karbon dengan energi yang sama.
Untuk menjelaskan keberadaan molekul CH4 ini, maka teori hibridisasi digunakan. Langkah awal hibridisasi adalah eksitasi dari satu (atau lebih) elektron:
Proton yang membentuk inti atom hidrogen akan menarik salah satu elektron valensi karbon. Hal ini menyebabkan eksitasi, memindahkan elektron 2s ke orbital 2p. Hal ini meningkatkan pengaruh inti atom terhadap elektron-elektron valensi dengan meningkatkan potensial inti efektif.
Kombinasi gaya-gaya ini membentuk fungsi-fungsi matematika yang baru yang dikenal sebagai orbital hibrid. Dalam kasus atom karbon yang berikatan dengan empat hidrogen, orbital 2s dengan tiga orbital 2p membentuk hibrid sp3 menjadi
Pada CH4, empat orbital hibrid sp3 bertumpang tindih dengan orbital 1s hidrogen, menghasilkan empat ikatan sigma. Empat ikatan ini memiliki panjang dan kuat ikat yang sama, sehingga sesuai dengan pengamatan.
sama dengan
Menurut teori hibridisasi orbital, elektron-elektron valensi metana seharusnya memiliki tingkat energi yang sama, namun spektrum fotoelekronnya menunjukkan bahwa terdapat dua pita, satu pada 12,7 eV (satu pasangan elektron) dan satu pada 23 eV (tiga pasangan elektron). Ketidakkonsistenan ini dapat dijelaskan apabila kita menganggap adanya penggabungan orbital tambahan yang terjadi ketika orbital-orbital sp3 bergabung dengan 4 orbital hidrogen.
Terimakasih atas infonya krisna, disini saya ingin bertanya diatas anda menjelaskan bahwa cis adalah gugus subtituen yang berikatan dengan ikatan rangkap berorientasi sama atau tidak berlawanan. Apa yang dimaksud dengan gugus subtituen? Mohon bantuannya.
BalasHapusDalam kimia organik, substituen adalah atom atau gugus atom yang bersubstitusi menggantikan atom hidrogen pada rantai induk hidrokarbon. Akhiran -il (yang berarti "melekat pada") digunakan dalam penamaan senyawa organik yang mengandung substituen. Selain itu, apabila diperlukan digunakan juga nomor-nomor posisional untuk menandakan atom karbon mana yang bersubstituen. Efek polar yang dihasilkan oleh sebuah substituen merupakan kombinasi efek induktif dan efek mesomerik. Cis : Gugus subtituen yang berikatan dengan ikatan rangkap berorientasi sama atau tidak berlawanan.Gugus subtituen bearti pada arah yang sama konformasinya adalah siklik dan jika sebaliknya adalah trans. Subtituen yang mempunyai elektronegativitas besar yang terikat pada atom karbon yang berdampingan dengan gugus karboksil akan memperbesar keasaman senyawa. Nah memberi nama senyawa aril halida sangatlah mudah. Gugus benzena yang kehilangan satu atom H nya akibat berikatan dengan X disebut benzil, kemudian tinggal ditambahkan nama halogennya.
HapusTata nama aril halida : Benzil halogen
Atau menyebutkan nama halogennya terlebih dahulu diikuti dengan nama gugus aromatik nya yaitu benzena.
Contoh : berilah nama senyawa berikut !
Senyawa 1
Nama senyawa diatas adalah : benzil bromida atau bromobenzena.
Jika ada subtituen lain selain halogen, maka penamaannya memakai aturan tata nama berikut.
Jika subtituen tersebut teletak satu hitungan C dari gugus halogen, maka nama senyawa diberi awalan (o)- yang berarti ortho.
Jika berjarak dua hitungan diberi awalan (m)- yang artinya meta dan jika tiga hitungan diberi awalan (p)-yang artinya para.
Untuk menghitung jaraknya dicari arah sehingga subtituen itu mendapat nomor yang kecil.
Karena berjarak satu hitungan dari C - Cl, maka senyawa diatas kita beri awalan (o)-. Kita menghitungnya tidak berlawanan arah jarum jam karena gugus -CH3 nya akan mendapat nomor 5. Tetapi menghitungnya searah jarum jam sehingga -CH3 mendapat nomor 1 dan kecil.Nah memberi nama senyawa aril halida sangatlah mudah. Gugus benzena yang kehilangan satu atom H nya akibat berikatan dengan X disebut benzil, kemudian tinggal ditambahkan nama halogennya.
Tata nama aril halida : Benzil halogen
Atau menyebutkan nama halogennya terlebih dahulu diikuti dengan nama gugus aromatik nya yaitu benzena.
contoh senyawa seperti: benzil bromida atau bromobenzena.
Jika ada subtituen lain selain halogen, maka penamaannya memakai aturan tata nama berikut.
Jika subtituen tersebut teletak satu hitungan C dari gugus halogen, maka nama senyawa diberi awalan (o)- yang berarti ortho.
Jika berjarak dua hitungan diberi awalan (m)- yang artinya meta dan jika tiga hitungan diberi awalan (p)-yang artinya para.
Untuk menghitung jaraknya dicari arah sehingga subtituen itu mendapat nomor yang kecil.
Contoh :
Senyawa 2
Karena berjarak satu hitungan dari C - Cl, maka senyawa diatas kita beri awalan (o)-. Kita menghitungnya tidak berlawanan arah jarum jam karena gugus -CH3 nya akan mendapat nomor 5. Tetapi menghitungnya searah jarum jam sehingga -CH3 mendapat nomor 1 dan kecil.
Bisakah Anda memberikan contoh pada ikatan cis dan trans? Terimakasih
BalasHapusisomer sistem cis-trans adalah cara yang paling umum di gunakan untuk menunjukkan konfigurasi alkena. cis mengandung pengertian bahwa subtituen terletak pada bidang yang sama, sedangkan trans mengandung pengertian bahwa subtituen terletak pada bidang yang berseberangan. dengan sistem ini tidak lagi di jumpai keraguan isomer manakah yang diberi nama cis-2-butena dan manakah trans-3-heksena. contoh isomer cis dan trans yaitu cis-2-butena dan Trans-3-heksena
Hapusuntuk alkena yang lebih kompleks, orientasi atom-atom pada rantai utama menentukan apakah alkena termasuk cis atau trans. Misalnya, rumus struktur isomer cis-3,4-dimetil-2-pentena. pada contoh ini atom-atom karbon rantai utama nomor 1 dan 4 terletak pada sisi yang sama terhadap ikatan rangkap,sehingga di beri nama Cis.
selain itu, Isomer geometri terjadi pada senyawa yang mempunyai ikatan rangkap dua dan gugus yang terikat pada atom karbon yang mempunyai ikatan rangkap tersebut berbeda atau sama. Hal ini terjadi karena ikatan rangkap dua, C=C pada senyawa tersebut tidak dapat berputar dengan bebas. Berdasarkan posisi atom/gugus atomnya, isomer-isomer geometri dibedakan :
· Isomer cis, yaitu isomer di mana atom/gugus atom sejenis berada pada sisi yang sama (berdampingan).
· Isomer trans, yaitu isomer di mana atom/gugus atom sejenis berada pada sisi bersebrangan.
Pada isomer cis-trans : harus ada dua gugus yang berlainan yang terikat pada masing-masing karbon ikatan rangkap.
Contoh : cis-2-butena dan trans-2-butena.
terima kasih informasinya
BalasHapusSaya ingin bertanya,, manakah yang lebih stabil antara cis dan trans?? Tolong berikan alasannya
Isomer cis dan isomer trans sering kali memiliki sifat-sift fisika yang berbeda. Perbedaan antara isomer pada umumnya disebabkan oleh perbedaan bentuk molekul atau momen dipol secara keseluruhan. Perbedaan ini dapatlah sangat kecil, seperti yang terlihat pada titik didih alkena berantai lurus 2-pentena (titik didih isomer trans 36 °C dan isomer cis 37 °C)[1]. Perbedaan isomer cis dan trans juga dapat sangat besar, seperti pada kasus siklooktena. Isomer cis senyawa ini memiliki titik didih 145 °C[2], sedangkan isomer transnya 75 °C.[3] Perbedaan yang sangat besar antara kedua isomer siklooktena disebabkan oleh terikan cincin yang besar untuk trans-siklooktena, yang juga menyebabkannya kurang stabil dibandingkan isomer cis. Bahkan, kedua isomer asam 2-butenadioat memiliki sifat-sifat dan reaktivitas yang sangat berbeda sehingga mempunyai nama yang berbeda pula. Isomer cisnya disebuah asam maleat, sedangkan isomer transnya disebuat asam fumarat. Polaritas merupakan faktor kunci yang menentukan titik didih relatif senyawa karena ia akan meningkatkan gaya antar molekul, sedangkan simetri merupakan faktor kunci yang menentukan titik leleh relatif karena ia mengizinkan penataan molekul yang lebih baik pada bentuk padat. Oleh karena itu, trans-alkena yang kurang polar dan lebih simetris cenderung memiliki titik didih yang lebih rendah dan titik leleh yang lebih tinggi. Sebaliknya cis-alkena secara umum memiliki titik didih yang lebih tinggi dan titik leleh yang lebih rendah.Sistem penamaan isomer cis/trans tidaklah efektif ketika terdapat lebih dari dua substituen pada ikatan ganda. Notas E/Z dapat digunakan untuk kasus seperti ini. Z (berasal dari Bahasa Jerman zusammen) berarti bersama dan berkorespondensi dengan istilah cis; E (berasal dari Bahasa Jerman entgegen) berarti berlawanan dan berkorespondensi dengan istilah trans.
HapusSebuah konfifurasi molekul disebut E atau Z tergantung pada kaidah prioritas Cahn-Ingold-Prelog (nomor atom yang lebih tinggi memiliki prioritas lebih tinggi). Untuk setiap atom yang melekat pada ikatan ganda, diperlukan penentuan substituen mana yang memiliki prioritas lebih tinggi. Jika dua substituen berprioritas leih tinggi berada pada sisi yang sama, susunan ini disebut Z; sedangkan jika berlawanan, susunan ini disebut E.
Isomer trans-2-butenaterdapat dalam jumlah berlebih (76%) dibandingkan isomer cis-2-butena yang hanya 24%. Dengan menggunakan konstantakesetimbangan, dapat dihitung bahwa cis-2-butena kurang stabil dibandingkan trans-2-butena dengan perbedaan nilai2,8 kJ/mol pada suhu ruang.
selamat malam gea saya ingin bertanya, mengapa diperkirakan bahwa benzena memiliki ciri-ciri khas seperti yang dimiliki oleh alkena?
BalasHapusDengan dasar dugaantersebut maka dapat diperkirakan bahwa benzena memiliki ciri-ciri khas seperti yang dimilikioleh alkena. Perkiraan tersebut ternyata jauh berbeda dengan kenyataannya, karena benzenatidak dapat bereaksi seperti alkena (adisi, oksidasi, dan reduksi). Lebih khusus lagi benzenatidak dapat bereaksi dengan HBr, dan pereaksi-pereaksi lain yang lazimnya dapat bereaksidengan alkena. Sifat-sifat kimia yang diperlihatkan oleh benzena memberi petunjuk bahwasenyawa tersebut memang tidak segolongan dengan alkena ataupun sikloalkena.Senyawa benzena dan sejumlah turunannya digolongkan dalam
Hapussenyawa aromatik,
Penggolongan ini dahulu semata-mata dilandasi oleh aroma yang dimiliki sebagian darisenyawa-senyawa tersebut. Perkembangan kimia pada tahap berikutnya menyadarkan parakimiawan bahwa klasifikasi senyawa kimia haruslah berdasarkan struktur dan kereaktifannya,dan bukan atas dasar sifat fisikanya. Saat ini istilah aromatik masih dipertahankan, tetapimengacu pada fakta bahwa semua senyawa aromatik derajat ketidakjenuhannya tinggi danstabil bila berhadapan dengan pereaksi yang menyerang ikatan pi (
). Bila dibandingkan dengan senyawa hidrokarbon lain yang mengandung 6 buah atom karbon, misalnya heksana (C6H14) dapat diduga bahwa benzena mempunyai derajat ketidakjenuhan yang tinggi. Dengan dasar dugaan tersebut maka dapat diperkirakan bahwa benzena memiliki ciri-ciri khas seperti yang dimiliki oleh alkena. Perkiraan tersebut ternyata jauh berbeda dengan kenyataannya, karena benzena tidak dapat bereaksi seperti alkena (adisi, oksidasi, dan reduksi). Lebih khusus lagi benzena tidak dapat bereaksi degan HBr, dan pereaksi-pereaksi lain yang lazimnya dapat bereaksi dengan alkena.
Menurut Kekule (1873), struktur benzena dituliskan sebagai cincin beranggota enam(heksagon) yang mengandung ikatan tunggal dan rangkap berselang-seling.
Blognya sangat bermanfaat. thanks:)
BalasHapusIf you're looking to lose pounds then you absolutely need to jump on this brand new custom keto meal plan.
BalasHapusTo create this keto diet, certified nutritionists, personal trainers, and cooks joined together to develop keto meal plans that are effective, decent, money-efficient, and enjoyable.
From their launch in 2019, 100's of people have already completely transformed their figure and well-being with the benefits a smart keto meal plan can offer.
Speaking of benefits: clicking this link, you'll discover eight scientifically-proven ones offered by the keto meal plan.
As reported by Stanford Medical, It is indeed the SINGLE reason women in this country live 10 years more and weigh an average of 42 pounds lighter than us.
BalasHapus(And actually, it has NOTHING to do with genetics or some secret-exercise and absolutely EVERYTHING related to "HOW" they eat.)
P.S, I said "HOW", and not "what"...
CLICK on this link to reveal if this short quiz can help you find out your real weight loss possibilities