TUGAS
TERSTRUKUR III & IV
11. Megapa
reaksi bersaing antara subtitusi dan eliminasi bisa terjadi? Jelaskan!
jawab:
Reaksi
substitusi merupakan suatu reaksi dimana satu atom, ion atau gugus disubstitusikan (diganti) dengan atom, ion atau gugus
lain. Reaksi substitusi terdiri dari reaksi substitusi nukleofil (SN) dan reaksi substitusi elektrofil (SE).
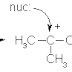
Jika suatu alkil halida dengan satu hidrogen yang melekat pada
karbon bersebelahandengan karbon pembawa halogen bereaksi dengan nukleofili,
dapat terjadi dua lintasan reaksi yang bersaing yaitu substitusi dan eliminasi.
H | | Substitusi (S) −C – C – Nu + X- H | | |2 |1 −C–C–X + Nu: - | | Eliminasi
(E) C=C + Nu – H + X- Dalam reaksi substitusi, nukleofili menggantikan halogen
X. dalam reaksi eliminasi,nukleofili bertindak sebagai basa dan mengambil
proton dari karbon-2, yakni karbon di sebelahatom karbon yang membawa halogen
X. halogen X dan halogen hidrogen dari atom karbon darisebelahnya
dieliminasikan, dan satu ikatan baru (ikatan pi) terbentuk diantara karbon-1
dan -2.Lambag E digunakan untuk menunjukan proses eliminasi. Oleh karena dalam
hal ini hidrogenhalida dieliminasi, reaksinya disebut dehidrohalogenasi. Reaksi
eliminasi merupakan cara yangberguna untuk membuat senyawa dengan ikatan
rangkap atau rangkap tiga. Ada dua mekanisme utama untuk reaksi elminasi yang
disebut sebagai E2 dan E1.Mekanime yang terjadi adalah:
Mekanisme E2 Mekanisme E2 merupakan proses
satu langkah. Nukleofili yang bertindak sebagai basa, mengambil proton
(hydrogen) pada atom karbon di sebelah atom karbon pembawa gugus pergi. Pada
waktu yang sama, gugus pergi meninggalkan tempat dan ikatan rangkap terbentuk.
Pemutusan ikatan dan pembentukan ikatan yang terjadi sewaktu berlangsungnya
reaksi E2 ditunjukkan dengan panah lengkung berikut:Nu:- ikatan pi H Nu – H C−C
E2 C C L L: - Konformasi yang disukai untuk substrat pada reaksi E2 juga pada
reaksi di atas. Atom-atom H-C-C-L terletak pada satu bidang datar, dengan H dan
L pada kedudukan anti.Kemudahan ini beralasan sebab ikatan C-H dan C-L
berkedudukan sejajar pada konformasi ini.Kesejajaran ini diperlukan untuk
membentuk ikatan pi yang baru sewaktu ikatan C-H dan C-Lputus.
Mekanisme E1 Mekanisme E1 merupakan proses dua
langkah dan lankah pertamanya sama seperti pada mekanisme SN1, yaitu ionisasi
substrat yang menentukan laju (lambat) untuk menghasilkan karbokation. H H | |
Lambat | | −C – C – L −C – C+ + : L- | | | | Substrat karbokation Dengan
demikian ada dua reaksi yang mungkin untuk karbokation. Karbokation dapat
bergabung dengan nukleofili (proses SN1), atau dapat kehilangan satu proton
dari atom karbon di sebeleh karbon positif missal ditunjukkan oleh panah
lengkung dan menghasilkan alkena (proses E1). H H Nu: - C – C – Nu SN1 | | −C –
C+ – | | -H+ C=C + H+ E1 Karbokation.
Mekanisme E2
juga memerlukan basa. Akan tetapi, pergantian posisi basa dan eliminasi gugus
lepas berlangsung secara serentak dan tidak menghasilkan zat antara ionik.
Berbeda dengan eliminasi E1, konfigurasi stereokimia yang berbeda dapat dihasilkan
dalam reaksi yang memiliki mekanisme E2 karena basa akan lebih memfavoritkan
eleminasi proton yang berada pada posisi-anti terhadap gugus lepas. Oleh karena
kondisi dan reagen reaksi yang mirip, eliminasi E2 selalu bersaing dengan
substitusi SN2. Kebalikan dari reaksi eliminasi adalah reaksi adisi.
Pada reaksi adisi, ikatan rangkap dua atau rangkap tiga diubah menjadi ikatan
rangkap tunggal. Mirip dengan reaksi substitusi, ada beberapa tipe dari adisi
yang dibedakan dari partikel yang mengadisi. Contohnya, pada adisi elektrofilik
hidrogen bromida, sebuah elektrofil (proton) akan mengganti ikatan rangkap
ganda dan membentuk karbokation, lalu kemudian bereaksi dengan nukleofil
(bromin). Karbokation dapat terbentuk di salah satu ikatan rangkap tergantung
dari gugus yang melekat di akhir. Konfigurasi yang lebih tepat dapat
diprediksikan dengan aturan Markovnikov. Aturan Markovnikov
mengatakan: "Pada adisi heterolitik dari sebuuah molekul polar pada alkena
atau alkuna, atom yang mempunyai keelektronegatifan yang besar, maka akan
terikat pada atom karbon yang mengikat atom hidrogen yang lebih sedikit."
Gugus alkil bersifat
pendonor electron dibandingkan hidrogen. Maka gugus alkil cenderung menetralkan
muatan positif parsial pada karbon karbonil, lalu menurunkan
reaktivitasnyaterhadap nukleofili. Keton memiliki dua gugus alkil sedangkan
aldehida hanya memiliki satu gugus alkil.
Reaksi
substitusi nukleofilik dan substitusi elektrofil dapat terjadi pada
senyawa alifatis dan senyawa aromatis. Elektrofil merupakan sesuatu yang tertarik pada elektron.
Dan karena tertarik oleh daerah negatif, elektrofil harus merupakan sesuatu
yang membawa muatan positif penuh atau memiliki sedikit muatan positif disuatu
daerah padanya.Eten dan alkena yang lain diserang oleh elektrofil. Elektrofilik
H∞+ Br∞-, biasanya ujung yang sedikit lebih positif (∞+) dari sebuah
molekul seperti hidrogen bromida (HBr). Reaksi substitusi nukleofil merupakan
suatu reaksi dimana satu atom, ion atau gugus molekul organik disubstitusikan
(digantikan) dengan suatu nukleofil. Adapun faktor – faktor
yang mempengaruhi reaksi substitusi sama halnya dengan reaksi eliminasi antara
lain struktur alkil halide, leaving group X- ,dan nukleofilik atau basa. Alkil
halida adalah turunan hidrokarbon di mana satu atau lebih hidrogennya diganti
dengan halogen. Tiap-tiap hidrogen dalam hidrokarbon potensil digantikan dengan
halogen, bahkan ada senyawa hidrokarbon yang semua hidrogennya dapat diganti.
Senyawa terfluorinasi sempurna yang dikenal sebagai fluorokarbon, cukup menarik
karena kestabilannya pada suhu tinggi. Pada reaksi substitusi, atom atau gugus
atom yang terdapat dalam suatu molekul digantikan oleh atom atau gugus atom lain.
Reaksi substitusi umumnya terjadi pada senyawa yang jenuh (semua ikatan
karbon-karbon merupakan ikatan tunggal), tetapi dengan kondisi tertentu dapat
juga terjadi pada senyawa tak jenuh.
Contoh:
Halogenasi hidrokarbon (penggantian
atom H oleh halogen)

Substitusi
Reaksi substitusi nukleofilik etil bromida bereaksi dengan ion hidroksida
menghasilkanetil alkohol dan ion bromida. HO- + CH3CH2 – Br H O 2 CH3CH2 – OH +
Br – Etil bromida etanol Ion hidroksida adalah nukleofili yang bereaksi dengan
substrat (etil bromida) danmenggantikan ion bromida. Ion bromida dinamakan
gugus pergi (leaving group). Dalam reaksijenis ini, satu ikatan kovalen
terputus, dan satu ikatan kovalen baru terbentuk. Dalam contoh ini,ikatan karbon-bromin
putus dan ikatan karbon-oksigen terbentuk. Gugus pergi (bromida)mengambil kedua
elektron dari ikatan-ikatan bromin dan nukleofili (ion hidroksida) memasokkedua
electron untuk ikatan karbon-oksigen yang baru. Gagasan ini merupakan
generalisasi dari persamaan di bawah ini untuk reaksi substitusinukleofilik:
Nu: + R : L R : Nu+ + : L- (a) Nukleofili netral substrat produk gugus pergi
Nu: - + R : L R : Nu + : L- (b) Nukleofili (anion) substrat produk gugus pergi
Bila nuklleofili dan substrat bersifat netral (a), produk akan bermuatan
positif. Bilanukleofili berupa ion negatif dan substratnya netral (b), maka
produknya akan netral. Hal iniberarti pasangan elektron bebas pada nukleofili
memasok elektron untuk ikatan kovalen yangbaru. Reaksi ini dapat reversible
karena gugus pergi juga memiliki pasangan elektron bebas yangdapat digunakan
untuk membentuk ikatan kovalen. Nukleofili dapat digolongkan berdasarkan jenis
atom yang membentuk ikatan kovalenbaru. Nukleofili yang sering dijumpai adalah
oksigen, nitrogen, sulfur, halogen, dan karbon.Contohnya:
Pada
reaksi eliminasi, molekul senyawa berikatan tunggal berubah menjadi senyawa
berikatan rangkap dengan melepas molekul kecil. Jadi, eliminasi merupakan
kebalikan dari adisi. Reaksi E2 (eliminasi bimolekular) ialah reaksi eliminasi
alkil halida yang paling berguna. Reaksi E2 alkil halida cenderung dominan bila
digunakan basa kuat, seperti –OH dan –OR, dan temperatur tinggi.
Secara khas reaksi E2 dilaksanakan dengan memanaskan alkil halida dengan K+ -OH
/ Na+ -OCH2CH3 dalam etanol.
Reaksi E2 berjalan tidak lewat suatu
karbokation sebagai zat-antara, melainkan berupa reaksi
serempak (concerted reaction) yakni terjadi pada satu tahap, sama seperti
reaksi SN2.Basa membentuk ikatan dengan hidrogen Elektron-elektron C-H
membentuk ikatan pi Brom bersama sepasang elektronnya meninggalkan ikatan sigma
C-Br.
Struktur keadaan
transisi dalam reaksi satu tahap ini adalah : Dalam reaksi E2, seperti dalam
reaksi E1, alkil halida tersier bereaksi paling cepat dan alkil halida primer
paling lambat. (Bila diolah dengan suatu basa, alkil halide primer biasanya
begitu mudah bereaksi substitusi, sehingga sedikit alkena terbentuk).
Efek isotop kinetik Sekelumit bukti
eksperimen yang membantu orang memahami mekanisme E2 ialah perbedaan dalam laju
eliminasi antara alkil halide berdeuterium dan tak berdeuterium. Perbedaan
dalam laju reaksi antara senyawa yang mengandung isotop yang berbeda
disebut efek isotop kinetik.
Contoh:
Eliminasi
air (dehidrasi) dari alkohol. Apabila dipanaskan dengan asam sulfat pekat pada
suhu sekitar 1800C, alkohol dapat mengalami dehidrasi membentuk alkena.

Untuk membedakan ketiga jenis reaski di atas dapat dilakukan
dengan melihat ciri2nya yang dengan mudah akan teramati :
·
Pada
reaksi subtitusi ruas kanan dan ruas kiri tidak terdapat ikatan rangkap atau
bila di ruas kiri ada ikatan rangkap maka ruas sebelah kanan masih ada ikatan
rangkap tersebut.
·
sedangkan
pada reaksi adisi mempunyai ciri ruas sebelah kanan (sebelum reaksi) terdapat
ikatan rangkap sedangkan di ruas sebelah kiri (setelah reaksi) ikatan rangkap
tersebut hilang atau berkurang dari rangkap 3 menjadi rangkap 2.
·
kemudian
pada reaksi eliminasi mempunyai ciri2 kebalikan dari reaksi adisi, yakni di
ruas sebelah kiri tidak ada ikatan rangkap kemudian di ruas sebelah kanan
menjadi ada ikatan rangkapnya.
2. Alkohol dapat diubah
menjadi eter atau sebaliknya. Jelaskan mengapa sifat kedua senyawa tersebut
berbeda kontras? berikan contohnya.
Jawab:
Sifat fisik alkohol dan eter
a.
Titik didih Telah disebut sebelumnya bahwa
alkohol dan eter dianggap sebagai air.
Hubungan ini menjadi jelas, terutama pada homolog yang lebih
rendah, jika kita membicarakan tentang sifat-sifat fisik dan kimia alkohol.
Ingat bahwa semua alkana –metana, etana, dan propana- merupakan gas dan tidak
larut dalam air. Sebaliknya alkohol –metanol, etanol, dan propanol merupakan
cairan dan larut dalam air. Penggantian satu atom hidrogen dengan gugus
hidroksil menyebabkan perubahan besar pada kelarutan dan keadaan fisik.
Perbedaan tersebut merupakan akibat dari kemampuan mengikat hidrogen pada
alkohol. Pengikatan hidrogen yang menyebabkan daya tarik menarik intermolekular
antar molekul-molekul alkohol. Bahkan homolog yang teringan merupakan cairan
pada suhu ruang. Alkohol dapat membentuk ikatan hidrogen dengan molekul air,
sehingga homolog yang lebih rendah larut dalam air. Titik didih alkohol yang
relatif tinggi merupakan akibat langsung dari daya tarik intermolekular yang
kuat. Ingat bahwa titik didih adalah ukuran kasar dari jumlah energi yang
diperlukan untuk memisahkan suatu molekul cair dari molekul terdekatnya. Jika
molekul terdekatnya melekat pada molekul tersebut sebagai ikatan hidrogen,
dibutuhkan energi yang cukup besar untuk memisahkan ikatan tersebut. Barulah
kemudian molekul tersebut dapat terlepas dari cairan menjadi gas.
pada alkohol Pada
alkohol gugus alkil tidak membentuk ikatan hidrogen sehingga satu molekul
terikat hanya dengan dua molekul alkohol yang lain.
Energi yang dibutuhkan untuk memisahkan tiga atau empat
ikatan molekular lebih besar daripada dua ikatan molekular, oleh sebab itu
energi yang dibutuhkan untuk menguapkan air lebih besar. Sedangkan pada eter
kedua alkil yang terikat pada oksigen tidak dapat membentuk ikatan hidrogen
sehingga eter mempunyai titik didih yang lebih kecil dibanding alkohol.
Kelarutan Untuk lebih memahami kelarutan alkohol dan eter
dalam air, lakukan percobaan kelarutan alkohol dan eter. Polaritas dan ikatan
hidrogen merupakan faktor yang menentukan besarnya kelarutan alkohol dan eter
dalam air. Dalam membahas kelarutan, kita menggunakan prinsip “like dissolves
like” yang berarti pelarut molar melarutkan zat terlarut polar dan pelarut non
polar melarutkan zat terlarut non polar. Tetapi prinsip tersebut tidak berlaku
untuk semua kasus. Semua alkohol adalah polar tetapi tidak semua alkohol dapat
larut dalam air. Alkohol dengan massa molekul rendah dapat larut dalam air
dengan baik. Kelarutan dalam air ini lebih disebakan oleh ikatan hidrogen
antara alkohol dan air. Semakin panjang rantai karbon semakin kecil
kelarutannya dalam air. Eter tidak dapat membentuk ikatan hidrogen antara
molekul- molekulnya, karena tidak ada hidrogen yang terikat pada oksigen.
Tetapi jika dicampur dengan air eter dapat membentuk ikatan hidrogen dengan
air. karena ikatan hidrogen dengan H2O inilah maka kelarutan dietil eter hampir
sama dengan 1-butanol. Kelarutan alkohol dan eter dalam air Nama Rumus
kelarutan (g/100 mL) Metanol Etanol 1-propanol 1-butanol dietil eter CH3OH
CH3CH2OH CH3CH2CH2OH CH3CH2CH2CH2OH CH3CH2OCH2CH3 Tak terhingga Tak terhingga
Tak terhingga 8,3 8,0.
Dehidrasi alkohol (pelepasan air)
biasanya terjadi apabila asam sulfat pekat berlebih dicampurkan dalam alkohol
dan memanaskan campuran tersebut hingga 180oC. Gugus hidroksil akan terlepas
dan atom hidrogen dari carbon terdekatnya juga terlepas, membentuk alkena. C C
H H H OH H H C C H H H H + HOHH2SO4pekat, 180o C Asam berlebih Pada kondisi
lain, yaitu penambahan sedikit asam sulfat pekat dan pemanasan dilakukan pada
suhu 140oC, maka akan terbentuk eter. Pada
reaksi ini melibatkan dua molekul alkohol. Alkohol pertama melepaskan gugus
hidroksil dan alkohol kedua melepaskan atom hidrogen. C C H H H H OH H C C H H
O H H H C C H H H H O H H C H H C H H H HOH H2SO4pekat,140 o C Alkohol berlebih
+ + b. Oksidasi alkohol Oksidasi alkohol telah anda pelajari pada saat
membedakan alkohol primer, sekunder dan tersier.
Reaksi alkohol dengan Na atau K Alkohol kering (tidak
mengandung air) dapat bereaksi dengan logam Na atau K sehingga atom H dari
gugus OH digantikan dengan logam tersebut sehingga terbentuk Na-alkoholat. R
OH2 + 2 Na 2 R ONa + H2 Alkohol Na-alkoholat C2H5 OH2 + 2 Na 2C2H5 ONa + H2
etanol Natrium etanolat Jika terdapat air maka alkoholat terurai kembali
menjadi alkohol + NaOH. C2H5 OH +C2H5 ONa + H2O NaOH d. Esterifikasi Alkohol dengan asam alkanoat dapat membentuk ester. Reaksi ini disebut dengan reaksi
esterifikasi. HOHCH3 C O OCH2 CH3HO+ CH2CH3 +CH3 C O OH Asam etanoat etanol
etil asetat (suatu ester) e. Sifat kimia eter Eter bersifat inert seperti
halnya alkana, eter tidak bereaksi dengan aksidator, reduktor maupun basa.
Karena sifat inilah eter banyak digunakan sebagai pelarut organik.
Alkohol yang mempunyai dua gugus
hidroksil disebut alkohol dihidrat, dan yang mempunyai tiga gugus hidroksil
disebut alkohol trihidrat.
Alkohol dihidrat sering disebut glikol. Yang paling penting
dari jenis ini adalah etilen glikol. Nama IUPAC dari etilen glikol adalah
1,2-etanadiol. Senyawa ini merupakan bahan utama pada campuran antibeku
permanen untuk radiator kendaraan bermotor. Etilen glikol adalah cairan yang
manis, tak berwarna dan agak lengket. Karena keberadaan dua gugus hidroksil, maka
ikatan intermolekul hidrogen menjadi lebih besar. Oleh sebab itu etilen glikol
mempunyai titik didih yang tinggi (198oC) dan tidak menguap jika dipakai
sebagai anti beku. Etilen gikol juga mudah bercampur dengan air. Suatu larutan
60% etilen glikol dalam air tidak membeku sampai suhunya turun hingga -49oC .
Etilen glikol juga digunakan pada pembuatan fiber poliester (dacron) dan film
magnetik (mylar) yang digunakan untuk pita pada kaset dan komputer, Etilen
glikol agak beracun. Seperti halnya metanol, tingkat keracunannya dikarenakan
proses metabolisme dalam tubuh. Enzim hati mengoksidasi etilen glikol menjadi
asam oksalat: CH2 OH CH2 OH Enzim hati CHO C O OH O etilen glikol asam oksalat. Sifat-sifat fisik ester , Molekul-molekul
ester bersifat polar namun tidak mampu membentuk ikatan hidrogen intermolekuler
satu dengan yang lain. Karenanya ester mempunyai titik didih yang lebih rendah
daripada asam karboksilat isomernya. Seperti yang dapat diduga titik didih
ester terletak antara keton dan eter dengan massa molar yang sebanding. Karena
molekul-molekul ester dapat membentuk ikatan hidrogen dengan molekul-molekul
air, ester dengan massa molar rendah larut dalam air. Ester yang memiliki tiga
hingga lima atom karbon larut dengan baik dalam air. Tabel 3 menunjukkan
sifat-sfifat fisik beberapa ester yang umum dijumpai. Sifat kimia Larutan asam
karboksilat dalam air bersifat asam. larutan tersebut dapat mengubah lakmus
biru menjadi merah.Semua asam karboksilat dapat bereaksi dengan larutan NaOH,
Na2CO3 dan NaHCO3.
Kegunaan dan dampak dari penggunaan Alkohol Dan Eter Metanol
Dalam industri metanol diubah menjadi formaldehid atau digunakan untuk mensintesa
bahan kimia lain. Metanol digunakan sebagai pelarut dan sebagai bahan bakar
bersih. Metanol mungkin juga mempunyai kegunaan baru dalam bidang pertanian.
Pada awal tahun 1990-an Arthur Nonomura, seorang ilmuan yang menjadi petani,
menemukan bahwa dalam kondisi panas menyemprotkan larutan cairan metanol pada
beberapa tumbuhan dapat menggandakan tingkat pertumbuhannya dan mengurangi
kebutuhan air hingga separuhnya. Nonomura menyadari bahwa pada saat-saat panas
dipertanian beberapa tumbuhan menjadi layu. Berdasarkan risetnya sebagai
ilmuwan ia menyemprot beberapa tumbuhan dengan larutan metanol yang sangat
encer. Tumbuhan yang disemprot tidak lagi layu dan tumbuh lebih besar pada
tingkat yang lebih cepat daripada tumbuhan yang tidak disemprot. Akan tetapi
metanol akan efektif dalam kondisi panas atau terkena sinar matahari dan untuk
tumbuhan kapas, gandum, strawberi, melon dan mawar. Kegunaanya dapat terlihat
jelas, hasil tanaman lebih banyak dan lebih cepat, penggunaan air lebih
efisien, dan tidak diperlukannya pestisida. Tidak seperti alkohol pada minuman,
metanol tetap beracun meskipun dalam jumlah kecil. Gejala keracunan metanol
adalah kebutaan karena metanol menyerang syaraf penglihatan; juga dapat
berakibat kematian. etanol Pada kebanyakan orang dewasa metabolisme tubuh dapat
mencerna sejumlah kecil etanol dengan tingkat keracunan yang rendah. Etil
alkohol pada umumnya disebut alkohol padi-padian atau alkohol minuman karena
dapat dihasilkan dari fermentasi gula alam dan tepung yang dihidrolisa yang terdapat
pada anggur dan padi-padian.
- Sifat Eter
Sifat-sifat eter adalah sebagai berikut.
Pada suhu rendah mudah menguap dan uapnya mudah terbakar.
Sukar larut dalam air dan berbau khas.
Titik didihnya lebih rendah daripada alkohol yang jumlah atom C-nya sama.
Tidak bereaksi dengan logam Na / K.
Tidak bereaksi dengan PCl3 / PCl5.
Dapat diuraikan oleh asam halogenida (HX) menjadi alkil halogenida dan alkohol.
Eter dapat melarutkan lemak, minyak, resin, alkaloid, bahkan zat-zat anorganik seperti misalnya brom, iod, dan beberapajenis garam
Pada suhu rendah mudah menguap dan uapnya mudah terbakar.
Sukar larut dalam air dan berbau khas.
Titik didihnya lebih rendah daripada alkohol yang jumlah atom C-nya sama.
Tidak bereaksi dengan logam Na / K.
Tidak bereaksi dengan PCl3 / PCl5.
Dapat diuraikan oleh asam halogenida (HX) menjadi alkil halogenida dan alkohol.
Eter dapat melarutkan lemak, minyak, resin, alkaloid, bahkan zat-zat anorganik seperti misalnya brom, iod, dan beberapajenis garam
- Membedakan Alkohol dengan Eter
Alkohol dan eter merupakan isomer fungsi dengan rumus
umum CnH2n+2O. Namun demikian, kedua homolog ini mempunyai sifat-sifat yang
berbeda nyata, baik sifat fisis maupun sufat kimia. Alkohol mempunyai titik
cair dan titik didih yang jauh lebih tinggi daripada eter yang sesuai. Hal itu
terjadi karena gugus fungsi alkohol (-OH) bersifat polar dan menyebabkan adanya
ikatan hidrogen antarmolekul alkohol, sedangkan eter bersifat kurang polar dan
tidak terdapat ikatan hidrogen.
Perbedaan yang cukup nyata juga tampak pada kelarutannya dalam air. Kelarutan alkohol dalam air jauh lebih besar daripada eter. Hal ini juga berkaitan dengan gugus fungsi alkohol yang bersifat polar. Antara alkohol dan air dapat membentuk ikatan hidrogen.
Metanol dan etanol larut sempurna dalam air. Kelarutan alkohol berkurang seiring dengan bertambah panjangnya rantai karbon. Hal itu terjadi karena rantai alkil merupakan gugus yang nonpolar, sehingga interaksi dengan air makin lemah. Hal yang serupa terjadi pada eter, tetapi kelarutan eter jauh lebih kecil.
Secara kimia, alkohol dan eter dapat dibedakan berdasarkan reaksinya dengan logam natrium dan fosforus pentaklorida.
Alkohol bereaksi dengan logam natrium membebaskan hidrogen, sedangkan eter tidak bereaksi.
Alkohol bereaksi dengan PCl5 menghasilkan gas HCl, sedangkan eter bereaksi tetapi tidak menghasilkan HCl.
Perbedaan yang cukup nyata juga tampak pada kelarutannya dalam air. Kelarutan alkohol dalam air jauh lebih besar daripada eter. Hal ini juga berkaitan dengan gugus fungsi alkohol yang bersifat polar. Antara alkohol dan air dapat membentuk ikatan hidrogen.
Metanol dan etanol larut sempurna dalam air. Kelarutan alkohol berkurang seiring dengan bertambah panjangnya rantai karbon. Hal itu terjadi karena rantai alkil merupakan gugus yang nonpolar, sehingga interaksi dengan air makin lemah. Hal yang serupa terjadi pada eter, tetapi kelarutan eter jauh lebih kecil.
Secara kimia, alkohol dan eter dapat dibedakan berdasarkan reaksinya dengan logam natrium dan fosforus pentaklorida.
Alkohol bereaksi dengan logam natrium membebaskan hidrogen, sedangkan eter tidak bereaksi.
Alkohol bereaksi dengan PCl5 menghasilkan gas HCl, sedangkan eter bereaksi tetapi tidak menghasilkan HCl.